主要包括mRNA 5’端非翻译区(5’2 U TR)、基因的A +T 组成和密码子的使用频率3 个方面。由于巴斯德毕赤酵母中乙醇氧化酶的表达量极高(占胞内可溶蛋白的30% 以上) 因此为了有高的蛋白表达量,维持外源基因mRNA 5’-U TR。尽可能和AOXlmRNA 5’-U TR 相似是必需的, 最好是保持两者一致。A + T 含量高的基因在巴斯德毕赤酵母中表达时偶尔会造成转录提前终止,这是因为A T 丰富区可能存在转录提前终止信号。因此对A T 含量丰富的基因最好是重新设计序列, 使其A + T 含量在30%~ 55% 范围内。
巴斯德毕赤酵母也有特殊的密码子偏好趋向。(赵翔,霍克克,李育阳. 毕赤酵母的密码子用法分析[J ] . 生物工程学报,2000 ,16(3) :308 - 311.)
外源蛋白自身的理化特点也影响其表达和分泌。外源蛋白的加工修饰都会影响蛋白的表达量。
2.选择强启动子
启动子在转录水平上调控基因的表达最常用的启动子是AOXI 启动子。PGAG(三磷酸甘油醛脱氢酶启动子) 是最近在巴斯德毕赤酵母中克隆到的一个组成型启动子,在它的控制下β- LabZ 基因表达率比甲醇诱导下的PAOX驱动的产量更高,由于该组成型启动子不需要甲醇诱导,发酵工艺应该更简单,同时其产量更高,所以成为代替PAOX1 最有潜力的启动子。
通过分离选择恢复利用甲醇能力的自发突变体, 从AOX1 基因缺陷菌株中分离M ut+ 的自发突变体,从中筛选提高表达量的突变体。(戴秀玉, 王恂, 周坚1 毕赤氏酵母PAOX2 突变化序列分析〔J 〕1微生物学报, 1999, 39 (6) : 559~ 5611)
3.增加外源基因整合拷贝数
(1)Invitrogen 公司最新发展的质粒pPIC9K上带有G418 的抗性基因,可以通过转化子对G418抗性水平快速筛选高拷贝转化子(配合电激法转化的效果更好)。
(2)在体外载体上多次插入目的基因片段。
(3)将载体中目的基因两端连上来自宿主或其它非必需高重复的基因片段, 通过同源重组而达到高拷贝整合的目的。(聂东宋, 梁宋平, 李敏1 外源蛋白在巴氏毕赤酵母中高效表达的策略〔J〕1 吉首大学学报(自然科学版) , 2001, 22 (3) : 40~ 41)
4.载体和宿主的选择
KM71转化子是muts 表型,而GS115 转化子主要是mut + 表型,也有一小部分是muts 表型。哪一种表型对外源蛋白的表达量更高,对每一种蛋白而言是不确定的。信号肽也是影响分泌表达水平的很重要因素。α- 交配因子和目的基因之间插入一个间隔肽(spacer peptide) 可以提高外源蛋白的表达水平。(王燕,梁镇和,张友尚,等. 人胰岛素在甲醇酵母Pichiapa storis 中的分泌表达[J ] . 生物化学与生物物理学报,1999 :31(5) :587 - 589.)
5.优化发酵条件
发酵条件主要包括通气量、温度、pH、甲醇含量和培养时间等。
5.1通气量是影响表达水平的极为重要的因素。
用发酵罐进行培养,外源蛋白的表达水平要比普通摇瓶发酵高出10~100 倍.主要原因是普通摇瓶发酵的通气不理想,影响了菌体的高密度生长及表达。许多文献报道的表达水平都是摇瓶发酵条件下的结果,可以推测,如果用发酵罐进行培养,表达水平还会有上升的空间。
5.2碳源也是影响高水平表达的重要因素。
毕赤酵母表达培养基常用的碳源是甘油, 但甘油对AOX 启动子有抑制作用。山梨糖醇代替甘油作为碳源, 结果生物质量下降, 但外源蛋白的表达有所提高
5.3培养基组成
目前主要有BM GY、FBS 2 种培养基可用于培养P. pastoris。但由于BM GY 既含有磷酸缓冲液又含蛋白胨和酵母提取物, 因而菌株生长更好, 大大增加了生物量, 使表达量也相应大大提高。
5.4甲醇诱导的方式、用量、诱导时间
诱导的方式:两步法(先用甘油培养使细胞达到一定的浓度,再加甲醇诱导) 和联合生长培养的方法(growth - associated ,在早期加入甲醇诱导) 来诱导外源蛋白的表达都有成功的报道。现在一般两步法来诱导外源蛋白的表达。用两步法来诱导外源蛋白的表达,则诱导时的起始pH 可能是毕赤酵母高效表达重组蛋白的关键之一,通过改变诱导时的pH 值,可使表达量提高50 %以上。(邱荣德,朱建蓓,王垒,等. 人p53 蛋白在巴斯德毕赤酵母中的表达[J ] . 生物工程学报,1999 ,15(4) :477 - 481.)
growth - associated 是诱导甲醇酵母高水平表达外源基因的很好方法,比普通方法高出10 倍(Ohashi R ,Mochizuki E ,Suzuki T. A mini - scale mass production and separation systemfor secretory heterologous proteins by perfusion culture of recombinant Pichia pastoris using a shaken ceramic membrane flask[J ] . Journal of Bioscience & Bioengineering ,1999 ,87 (5) :655 - 660.)
用量:一般甲醇添加量为0. 5 %~1 %
诱导时间(150h):过短的时间(3d) 表达量很低,过长的时间外源蛋白的降解增加,因此寻求一个最佳产量时间比就特别重要。
5.4蛋白酶的影响:
有些蛋白质,尤其是小分子肽易于受到蛋白酶(在中性pH条件下容易产生) 的影响。pH 降到3 或更低,使得许多中性pH蛋白酶失活,毕赤酵母能对抗低pH 值,因此低pH 不会影响其生长。也可以考虑用蛋白酶缺失菌株SMD1168 作宿主进行表达。
毕赤酵母
毕赤酵母简介:
甲醇营养型毕赤酵母优点:
(1)具有醇氧化酶AOX1基因启动子,这是目前最强,调控机理最严格的启动子之一;
(2)表达效率高,其表达的外源蛋白可占总表达蛋白的90%以上,有利于目的蛋白的分离纯化;
(3)在简单合成培养基中可实现高密度培养;
(4)表达质粒能在基因组的特定位点以单拷贝或多拷贝的形式稳定整合;
(5)由于该酵母可以以甲醇为唯一的碳源和能源,而绝大多数微生物并不能以甲醇为碳源,可以减少污染。
甲醇营养型毕赤酵不足之处:
(1)发酵周期长
(2)甲醇易燃易爆有毒,存在一定的危险性
(3)筛选高产菌株需用的药物价格比较昂贵
(4)培养基和培养条件不成熟
毕赤酵母发酵生产外源蛋白的过程一般包括3个阶段:
(1)细胞增殖阶段(2)分批流加的过渡阶段(3)诱导表达阶段(甲醇)各阶段碳源都为限制性基质,其补加速率的动力学模型是高效表达的基础。
常用载体:
此载体还包含组氨醇脱氢酶基因(HIS4)选择标记及3'AOX1区。当整合型载体转化受体时,它的5'AOX1和3'AOX1能与染色体上的同源基因重组,从而使整个载体连同外源基因插入
到受体染色体上,外源基因在5'AOX1启动子控制下表达。毕赤酵母本身不分泌内源蛋白,而外源蛋白的分泌需要具有引导分泌的信号序列。而由89个氨基酸组成的酿酒酵母的分泌信号—α交配因子(α-factor)引导序列已经成功地引导了几种外源蛋白的分泌。分泌表达载体主要有:pPIC9,pPIC9K,pHIL-S1,pPICZα A,pYAM75P等。胞内表达载体主要有:pHIL-D2,pA0815,pPIC3K,pPICZ,pHWO10,pGAPZ, pGAPZa(Invitrogen),pPIC3.5K等。
工程菌株Y11430,MG1003,GS115 (AOX1),KM71,SMD1168。毕赤酵母宿主菌常用的有GS115和KM71两种,都具有HIS4营养缺陷标记。其中,GS115茵株具有AOX1基因,是Mut+,即甲醇利用正常型;而KM71菌株的AOX1位点彼ARG4基因插入,表型为Muts,即甲醇利用缓慢型,两种菌株都适用于一般的酵母转化方法。
多拷贝表达菌株的获得方式:
能的多拷贝插入;而体外整合可通过连接产生外源基因的串联插入。多拷贝表达菌株的获得方式有两种:一种是利用SDS-PAGE电泳、免疫杂交或菌落点杂交方法在大量的转化子中进行自然筛选。得到产量高的表达菌株。另一种在转化前将多个表达盒拷贝插入到单个载体中,而后再通过交换整合到受体染色体上。
表达蛋白纯化方法:
近些年,甲醇营养型毕赤酵母(Methylotrophic Yeast Pichia Pastoris)表达系统成为一优秀新型外源基因的真核表达系统1,2。它已广泛应用于商业化生产。
与常用的酿酒酵母表达系统相比,该系统具有以下优点:
1.毕赤酵母醇氧化酶(Alcohol oxidase,AOX1)基因的强启动子特适合于外源基因的调控表达,但它受甘油或葡萄糖等碳源的阻遏,而受甲醇的诱导且诱导极其精确3;
2.毕赤酵母基因操作技术和酿酒酵母(Sccharomyces cerevisiae)非常相似,后者是现代分子生物学中研究得透彻和应用很广的酵母表达系统;
3.具有日螓成熟的高密度发酵工艺,廉价的原料配方;
4.毕赤酵母对需氧生长有强的偏好,这一生理学特性使得它既能高密度发酵生长,亦有利于工业放大生产;
5.外源蛋白分泌的高效率性;
6.外源蛋白基因遗传稳定性高;
7. 外源目的蛋白表达率高。
8.作为真核生物,巴斯德毕赤酵母能使外源真核基因正确翻译和翻译后加工。
1. 1Pichia Pastoris表达宿主菌
1.2毕赤酵母表达载体
-AOX1)、多克隆位点(MCS)和一个从AOX1基因拷贝下来的终止序列(TT);同时,大多数载体包含作为筛选标记的组氨醇脱氢酶基因HIS4和细菌中进行拷贝增值而存在的序列(如ColE1緰厏通常含有一个外源基因表达框、AOX1启动子(5 复制起始点和抗氨苄基因);同时也含有AOX1 的非编码取序列,使外源基因能以替代或插入方式整合到染色体的AOX1部位。3
1.3外源蛋白在毕赤酵母中的表达
载体整合方式通常有三种:一是双位点互换(Double AOX1、外源基因和转录终止区AOXt的表达单元置换染色体上有完整功能的AOX1基因,产生的表达菌的表型为His+Muts(或Mut-)。由于AOX1基因被置换,只能靠微弱转录的AOX2基因,因此甲醇利用率很低,但它表达外源基因的效率高。虽然Muts在甲醇培养基中生长缓慢,但有时在摇瓶培养条件下表达量更高7,不过由于其达到表达量高峰的时间过于漫长(150-200小时),所以不适合工业生产。二是AOX1单位点互换(SingleAOX1及转录终止区。含5揰爀漀猀猀-over),发生在染色体AOX1位点和表达载体的5 Cross-over),发生在染色体AOX1位点和表达载体的AOX1区。外源基因的表达盒插在AOX1基因的上游或下游,这一过程可重复发生,即可获得更多拷贝的表达盒插入基因组内,AOX1基因仍然有活性,产生的表型是His+Mut+,这种His+Mut+转化子利用甲醇。三是HIS4单位点置换,发生在染色体HIS4位点和表达载体的HIS4位点,使得一个或多个表达盒插入在HIS4位点,产生的表型也是His+Mut+。HIS4区的整合方式为位点特异性单交换引起的基因插入,整合后使组氨酸缺陷型宿主(his4)恢复野生型。HIS4区或AOX1区位点的整合都使转化子具有HIS4基因,因而可利用表型差异来进行筛选。当然也有His4双交换,结果为His-Mut+,不能被检出而已。
分泌到发酵液中的外源蛋白由于复杂的环境很容易产生降解或灭活,其蛋白不稳定问题主要由毕赤酵母分泌的几种蛋白酶引起,在发酵罐中,降解尤为严重。。目前主要有三种方法10来解决蛋白的降解:第一,在培养基中加入富含氨基酸和多肽的蛋白胨或胳蛋白水解物等,通过增加蛋白酶作用的底物来缓解蛋白酶的水解作用。第二,通过改变培养基的pH来加以改善,毕赤酵母可在3.0~8.0的范围内生长,但不同的pH对蛋白酶的影响不同,适当的pH可以有效抑制蛋白酶的活性。第三,产物的稳定性也可通过用蛋白酶缺失的菌株来提高。
1.5甲醇营养型毕赤酵母成功表达的外源蛋白
自从1988年,一些医药和生物技术公司获得到了甲酵营养型毕赤酵母表达技术,其中大部分为医药制品,如白介素-2、人血清白蛋白、肿瘤坏死因子、乙型肝炎表面抗原、人巨细胞病毒(Cytomegalovirus)抗原、抗凝血因子水蛭素衍生物(Hirudin variants)、血管紧张肽-I转换酶等等,其中乙型肝炎表面抗原、重组人血清白蛋白和胰岛素类生长因子用该技术进行了商业化生产,另外一些即将进入市场26,27。至今有四十多种蛋白用该菌进行了表达。
1.6毕赤酵母Pichia Pastoris工程水平上的研究进展
基因工程毕赤酵母的高密度高表达的发酵过程优化是一个重要的研究内容,各研究者做了大量的实验研究工作,重点在碳源利用和甲醇诱导AOX合成和抑制上研究发酵过程控制策略,并结合氧的供应,pH调节和温度控制,针对Mut+,Muts等不同表型,形成了毕赤酵母发酵的不同工艺。菌体量可达到200克/升,外源蛋白表达量可达2-10克/升(如TNF、HSA等)。
甲醇营养型毕赤酵母表达外源蛋白时一般有二个阶段,一为酵母细胞营养生长阶段;二为外源蛋白表达阶段。酵母细胞生长阶段主要目的为达到一定的菌体量,因而需要价低且能使酵母细胞生长迅速的碳源,通常为甘油和葡萄糖,而葡萄糖易产生葡萄糖效应,因而多用甘油作为唯一碳源,表达相时由于毕赤酵母具有以甲酵作为唯一碳源和能源的特性,且外源基因就插入在能够利用甲醇的AOX基因中,当甘油用完时立刻补入甲醇诱导AOX基因产生醇氧化酶来利用甲醇,同时启动表达外源基因的AOX的启动子(PAOX)表达外源基因蛋白。因此,表达时只有用甲醇来诱导。
甲醇营养型毕赤酵母的氮源极其简单,通常为氨水。
甲醇营养型毕赤酵母培养的温度通常为30℃,如果温度过高,细胞生长和表达外源蛋白将受到抑制,并且色素增加;如果温度过低,由于培养是散热的,因而培养开支要增大,且复杂的操作要增加;
1.7总结与展望
近几年,毕赤酵母表达体系有了更为广泛的应用范围,表达的蛋白质包括酶、膜蛋白、抗原和抗体、调节蛋白等各种类型。和其它体系比较,它在表达真核蛋白方面有更好的应用,国内虽然起步较晚,但用此体系成功表达出胰岛素、乙型表面抗原、降钙素等。我们实验室成功表达人血清白蛋白达6g/L,远远超过国内报道的表达量1.0g/L,超过国外报道的最高表达量3.39g/L。
当然,毕赤酵母表达体系和其它体系一样,不是完美无缺的,低表达和表达失败的例子也在增多。如前面提到的蛋白水解问题,很多蛋白在毕赤酵母中只表达出蛋白片断或几条带共存,通过Western杂交表明是水解的结果;另外,对一些复合蛋白的分泌还不有效。
对毕赤酵母发酵工艺也需要进一步优化,因为,调整发酵中的pH、温度可以有效抑制蛋白酶的活性,稳定目的蛋白,提高蛋白表达量。我们实验室利用生物参数检测(OUR、CER、RQ)与控制技术对发酵进行在线分析,运用参数相关性分析对过程进行调控,使白蛋白表达量达到上升。
因此,毕赤酵母的更广泛应用还有待于此体系的进一步优化。在增强启动子、寄主菌的蛋白酶降解问题、发酵条件等方面得到突破后,毕赤酵母表达体系将有更好的应用前景。
概述:啤酒酿造中啤酒酵母是至关重要的,由于酿造过程中许多环境因素的影响,会有部分酵母死亡甚至产生自溶.当啤酒中有5%以上的啤酒酵母自溶时,啤酒会产生明显的酵母味、苦味和涩味,并伴随出现其他方面的质量问题.自溶酵母都是衰老的死酵母,实际酿造中不可能完全防止酵母细胞的自溶,只有控制自溶限度.以下几点是环境因素对酵母死亡及自溶的影响.
1、麦汁
麦汁通氧培养温度等条件一定的情况下, 麦汁的营养成分对啤酒酵母的代谢非常重要. 麦汁中a-氨基酸、可发酵性糖、pH值、无机盐及生长素等营养成分不合理,会导致酵母营养缺乏,代谢缓慢.酵母衰老,从而引起酵母的死亡及自溶的可能性.
2、无机离子
3、溶解氧
4、发酵条件
5、温度
6、压力
7、酵母添加量
8、杂菌
9、酒花
10、酶制剂
11、冲洗时间
酵母活体染色
1)核DNA和线粒体DNA
1.当细胞培养到约107细胞/ml时,离心(5秒)收集细胞,再悬浮在70%乙醇中。
2.固定5分钟或5分钟以上,用水洗2次。
3.将细胞悬浮在含有50ng/ml的4,6-二脒基-2苯基吲哚的封固剂中。1mg/ml的4,6-二脒基-2苯基吲哚母液可在-20℃下贮存。
4.用紫外滤片观察。
2)线粒体
1.在生长培养基中培养细胞达到约107细胞/ml时,加入100ng/ml 3,3’-二已基噁羰花青碘化物(DiOC6,Sigma D3652或Molecular Probes)用乙醇把1mg/ml母液稀释到1/104。
2.培养5分钟或5分钟以上,用荧光素滤片观察。
3)液泡
1.当细胞生长到约107细胞/ml时,离心收集细胞(5秒),悬浮在含有50mmol/L柠檬酸钠(pH4.0)的YPD中。
2.加CDCFDA(羧基-2’,7’-二氯-荧光素双乙酸盐)到终浓度为10μmol/L。
3.保温10分钟或10分钟以上,用荧光滤片观察。
4)牙痕和几丁质
1.用生长培养基培养细胞达107细胞/ml时,加100μg/ml Calcofluor(荧光发光剂28;Sigma F3543)(用水将1mg/ml母液稀释到1/10,母液可在-20℃下黑暗保存数星期)。
2.培养5分钟或5分钟以上,用水洗2次,用紫外滤片观察。
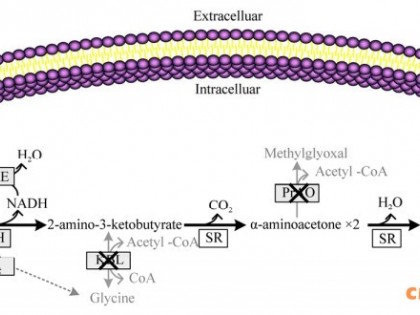
1.2 巴斯德毕赤酵母表达外源蛋白的降解机理及其控制策略
1.2.1 巴斯德毕赤酵母表达外源蛋白的降解机理
在外源蛋白的表达过程中,宿主菌毕赤酵母的胞内和胞外均有一定量的蛋白酶的表达,因此,不论是胞内表达亦或是分泌表达,大多数外源蛋白均面临着被降解的问题,这也是影响表达量的一个重要因素,同时,还增加了纯化目的蛋白的难度。近年来,蛋白酶的研究是P.pastoris表达系统一个重点和热点。越来越多的蛋白酶的遗传背景和生理生化性质得到深入的研究[52; 53]。P.pastoris能根据细胞生长环境(碳源的改变以及细胞或细胞器的胁迫)来调整自身酶系,以合成与降解不同的蛋白和细胞器,液泡是蛋白质降解最主要的场所[54],另一降解场所是细胞基质蛋白酶体中。但是,对于外源蛋白来说,其降解常在表达和分离纯化的第一步,主要是由培养基中胞外蛋白酶,细胞外膜结合蛋白酶(cell-bound proteases)[55]和细胞自噬或裂解释放的胞内蛋白酶降解的[5]。胞内蛋白酶主要涉及降解蛋白质前体产生活性蛋白;切除转运出膜后的蛋白质信号肽;使调控蛋白失活;降解变异或不需要的蛋白质;提供营养,前体和能量。胞外蛋白酶分泌较少,主要降解部分蛋白质提供氨基酸和多肽等营养[22]。根据蛋白酶的分泌和作用地点,P.pastoris的胞内蛋白酶可以分为三种类别,即液泡蛋白酶(vacuolar proteases),细胞基质蛋白酶体(the cytosolic proteosome)以及分泌途径的蛋白酶(proteases located along the secretory pathway)[52; 56]。
表1.2 毕赤酵母液泡蛋白酶和分泌途径蛋白酶[57]
Table 1.2 Proteases of Pichia pastoris vacuole and secretory pathway[57]
Enzyme
Vacuole
CpS
ApCo
Secretory pathway signal peptidase
酵母液泡位于基质中,一方面是维持胞内pH和盐离子平衡,储藏盐离子的功能;另一方面,由于液泡中含有大量的非特异性的水解酶,较宽底物范围的内生和异源蛋白酶,液泡是降解蛋白甚至细胞器的一个重要场所,大约80%的蛋白在液泡中降解[57]。在P.pastoris生长和表达外源蛋白过程中,由于碳源从葡萄糖或甘油到甲醇的改变,甲醇代谢酶系(AOX,FAD,DHAS等)和过氧化氢体逐步积累,同时,相应的蛋白酶也产生了。由于细胞器胁迫的影响,过氧化氢体一部分在基质中自噬降解,大部分过氧化氢体转运到液泡中得到降解[58]。P.pastoris中位于与细胞膜结合的胞内蛋白酶类可分为蛋白质水解酶(内切酶)和多肽外切酶,由蛋白酶,羧肽酶,氨肽酶类组成[53]。所有的蛋白酶都是由其蛋白酶前体经过酶切活化而成,按照其作用活性位点又分为4类,丝氨酸类蛋白酶、金属蛋白酶、半胱氨酸类蛋白酶和天冬氨酸类蛋白酶。丝氨酸类蛋白酶最适pH值比较高,又叫碱性蛋白酶,而天冬氨酸类蛋白酶需要低的pH范围,又叫酸性蛋白酶[22]。主要的液泡内蛋白酶有以下几种:蛋白酶A(proteinaseA,PrA),蛋白酶B(proteinase B,PrB),羧肽酶Y(carboxypeptidases Y,CpY),羧肽酶s(carboxypeptidases S,CpS),氨肽酶I (aminopeptidases I,ApI),氨肽酶Co(aminopeptidase Co,ApCo),二肽氨肽酶B(Dipeptidyl aminopeptidase B,DPAP-B)。蛋白酶A,分子量约42kDa,是天冬氨酸类蛋白酶,由基因PEP4表达[59],其前体能自身催化而形成成熟的蛋白酶,并催化羧肽酶Y前体和蛋白酶B前体形成羧肽酶Y和蛋白酶B;蛋白酶B,分子量约32kDa,丝氨酸类蛋白酶,由基因PRB1表达[60],对基因PRB1克隆和测序发现是一个很大阅读框,编码一个最少69 kDa的前提[60],其前体有50%的自身催化成蛋白酶B,另一部分由蛋白酶A催化;蛋白酶A和蛋白酶B是液泡中最基本的蛋白酶,是其他蛋白质水解酶的激活剂。羧肽酶Y,是丝氨酸类蛋白酶,由基因 PRCl编码, 其生物合成,液泡内分拣和CPY的加工成熟目前研究很清楚[61-63]。PRCl基因编码的羧肽酶Y前体包含一个N-端信号肽,一个含90个氨基酸的前肽和一个含421个氨基酸的酶活区域[64]。羧肽酶Y前体经过高尔基体后切除糖链得到一个69kDa的中间体,然后在液泡中切除前肽形成61 kDa成熟的羧肽酶Y。羧肽酶Y前体(67kDa)没有生物活性,必须在蛋白酶B作用下或蛋白酶A与蛋白酶B共同作用才能形成成熟的羧肽酶Y。羧肽酶S,是一个由基因CPSI编码,依赖于金属离子的羧肽酶,分子量73~77kDa[56].,其合成与膜和内质网相关。氨肽酶I,由基因LAP4编码,是一个含有12个亚基分子量为640 kDa的金属多肽[65],氨肽酶Co是一个分子量为100kDa 的Co2+金属多肽[66],其机理目前不清楚。二肽氨肽酶B,由基因DAP2 编码的膜接合液泡蛋白酶,在传递到液泡前没有蛋白酶活性[56; 67]。酵母液泡中的各种蛋白酶量会随着发酵过程中营养条件的改变发生变化,如发酵过程中的饥饿胁迫、碳源改变、热和pH变化及有毒有害产物的形成等。分泌到胞外的重组蛋白降解有可能是由于蛋白酶的过表达而部分分泌到胞外所致和高密度培养时细胞自溶造成膜破裂而释放出蛋白酶两种因素引起。在Sinha的研究中发现当P. pastoris从甘油生长阶段转为以甲醇为碳源诱导表达阶段时,培养基中的各种蛋白酶量明显增加,远高于一直以甘油作为碳源的实验对照组[68]。基质蛋白酶体,又称蛋白体,多蛋白酶复合体,多催化功能蛋白酶,存在于真核细胞内,主要完成蛋白酶水解途径的中间过程,其中20S的蛋白酶体,位于所有真核生物的细胞核和细胞间质中,是一个分子量为700 kDa 圆柱形颗粒,由14个不同的亚基折叠缠绕而成。26S蛋白酶体是一个巨型蛋白酶复合物,分子量高达1700 kDa,主要降解依赖 ATP的泛醌类蛋白质,它是由2个19S 蛋白酶体连接到20S 蛋白酶体两端构成[69],它们主要负责短周期的蛋白质的分拣和快速降解,包括某些对细胞有害的蛋白质。液泡和蛋白酶体降解的互作是调节细胞过程的一个重要方式,特别是对细胞胁迫的响应方面[53; 70]。分泌途径的蛋白酶主要分布在高尔基体和细胞质膜上,其功能是去处去除蛋白酶前体上的多肽[52],主要的蛋白酶有信号肽(Signal peptidase),Kex2蛋白酶(Kex2 Endoproteas ),Kexl 羧肽酶(Kexl carboxypeptidase)二肽氨肽酶A( Dipeptidyl Aminopeptidase A, DPAP-A),酵母天冬酰胺蛋白酶III (Yeast Aspartyl Protease III,Yap3 Protease)。信号肽是一个最少包含4个亚基的完整的膜蛋白[56]。Kex2蛋白酶,由基因KEX2编码,其功能是切除COOH-端的Lys-Arg or Arg-Arg 键残基 [71]。Kexl 羧肽酶,由基因KEXl 编码,是一个特异性的丝氨酸类蛋白酶,二肽氨肽酶A,由基因STE13编码的膜蛋白,酵母天冬酰胺蛋白酶III,其功能是在Kex2蛋白酶的作用下,切除受体COOH-端α因子前体[72]。在发酵过程中,由于高密度细胞的影响以及部分细胞的裂解,液泡中的蛋白酶常释放到培养基中,导致目的蛋白的降解。在发酵的过程中,随着外源蛋白在培养基中的浓度不断提高,蛋白水解酶浓度也随着升高,对外源蛋白产生降解作用。因此,防止蛋白水解酶的水解作用,提高外源蛋白的稳定性,减少外源蛋白的损失,也就相对地提高了外源蛋白的产量。
1.2.2 巴斯德毕赤酵母表达外源蛋白的降解控制策略
蛋白酶降解是酵母表达系统的共有一个缺陷,降解不仅能引起目的蛋白的产率下降,降解形成的片断还能造成分离纯化极大困难,特别是与目的蛋白分子量大小相差很小的降解产物,由于它们的理化性质接近,常规的分离方法很难将它们分离开来,导致产品收率大大下降,产品纯度低,蛋白的比活性降低。几乎所有在酵母中表达的重组蛋白都或多或少地存在表达蛋白降解问题,只是程度不同而已。而表达蛋白发生降解的不同程度往往是由于发酵培养条件和发酵控制方式不同所致。尽管降解程度有所不同,但引起蛋白降解的直接原因是酵母细胞自身存在的各种蛋白酶。
蛋白质的降解常引起目的蛋白产率的减少,生物活性的降低,并在分离纯化过程中降解产物由于类似的物化或亲和性质而造成产物污染[5]。P. pastoris表达外源蛋白时的蛋白降解控制策略日益受到重视。为避免蛋白酶的降解,不同的策略得到应用,如2使用蛋白酶缺陷菌株(protease deficient strains), 对蛋白质结构进行修饰(modification of the protein structure), 添加蛋白酶抑制剂(addition of protease inhibitors),改变培养基pH( changing the pH of the culture medium)以及添加在培养基中补加,如酪蛋白水解物(Casamino acids)、蛋白胨(yeast peptone)等一些富含氨基酸和多肽的组分。归纳起来可以分为三种水平策略:培养水平(cultivation-level strategies),细胞水平( cellular-level strategies )和蛋白质水平策略(protein-level strategies)[5]。
1.2.2.1 培养水平策略
提高分泌蛋白的稳定性可通过改变培养基的pH来加以改善。P. pastoris的pH适应范围比较广,可以在pH 2.8~7的范围内生长。不同的蛋白酶有不同的最佳pH作用范围,选择适当的发酵pH可以不影响细胞的生长,但可降低蛋白酶活性,减少目的蛋白的降解。P. pastoris在pH 3.0条件下发酵重组水蛭素比pH 5.0下的降解少[73]。pH 6.0 最适人表皮生长因子[20]和白蛋白[74]的表达,在pH 3.0 最适人胰岛素样生长因子、CD4蛋白的V1亚基表达,而咖啡豆半乳糖苷酶在pH4~5不降解,pH高或低均降解,pH 3.0最严重[5; 20; 75]。
低温能影响目的蛋白的产量,主要是由于温度较高时,重组蛋白不稳定,以及死细胞释放的蛋白酶的活性增强[76]。Li等[77]实验说明将培养温度从30℃降低到23℃时,毕赤酵母表达鲱鱼抗冻蛋白从5.3mg/L上升到18.0mg/L, 同时也发现活细胞率(cell viability)增加。Hong et al.通过降低发酵温度(从30℃降到 20℃)使表达的laccase活性增强[78]。Jahic et al.[79]应用温度限制流加发酵技术(a temperature-limited fed-batch technique,TLFB)获得了更高浓度的融合蛋白,同时细胞死亡率和蛋白酶活性都降低。通过添加特异性蛋白酶抑制剂也可减少目的蛋白的降解[80]。Shi et al [81]利用毕赤酵母表达抗Mamestra configurata serpin单链抗体(scFv)时候,鉴定到存在三种蛋白酶类,即天冬氨酸型蛋白酶、半胱氨酸型蛋白酶及丝氨酸型蛋白酶。通过添加丝氨酸蛋白酶抑制剂,发现发酵液总蛋白酶活性下降53%,添加天冬氨酸蛋白酶抑制剂,总蛋白酶活性下降30%。不过,大规模表达外源蛋白时添加特异性蛋白酶抑制剂使生产成本大幅度上升[81]。另外,尽管特异性蛋白酶抑制剂可提高产物的稳定性,但必须注意的问题是蛋白酶抑制剂与培养基的结合能显著改变部分蛋白组成。例如加入5mM EDTA到毕赤酵母发酵液培养时会引起一个分子量近50 kDa的蛋白分子在发酵液中的积累,该蛋白序列与S.cerevisiae 和Candida albilabs的exo-B-1,3-glucanase序列很接近[5]。
在培养基中补加一些富含氨基酸和多肽的组分,如酪蛋白水解物(Casamino acids)、蛋白胨(yeast peptone)、胃蛋白酶水解物等,为蛋白水解酶提供过量的底物,以减少目的蛋白的降解[75]。加入Casamino acid或YP到培养基中,进一步提高产物的稳定性。把培养基中的pH从5.2增加到6.0,则可显著提高分泌的rHSA产量,再加入YP又可提高其表达的产量[82]。通过添加1% Casamino acids,mouse epidermal growth factor (mEGF)表达量显著提高[30]。对于是加入Casamino acid 还是加入YP,通常认为最好加入Casamino acid,因为YP的肽组成会影响产物的分析和提取。直接添加氨基酸也能有效防止目的蛋白被降解。Won-A Choi等[50]认为0.3M L-Arg和L-Lys能够有效地防止目的蛋白被胞内蛋白酶酶解。
发酵时控制一定的比生长速率,或利用连续培养的发酵方式。细胞比生长速率同样可影响目的蛋白的降解。通过控制诱导相比生长速率为0.02–0.047h−1,即相应的甲醇浓度为3.09 g/L时候, 毕赤酵母表达水蛭素的降解可控制到最小程度[83]。
1.2.2.2 细胞水平策略
产物的稳定性也可通过改造毕赤酵母表达宿主的蛋白酶缺陷型菌株来提高。如SMD1168(his4,pep4)、SMD1165(his4,prb1)和SMD1163(his4,pep4,prb1)[84]。这些菌株在编码蛋白酶A(pep4)和/或蛋白酶B(PRB1)的基因中都有断裂,从而不能表达这些蛋白酶,并且影响其他蛋白酶的加工与成熟[34]。这些蛋白酶缺失的菌株在insulin-like growth factor-I、ghilanten和laccase的表达中被证明是有效的[37; 85]。这主要是因为使用蛋白酶缺陷型菌株后重组蛋白的降解减少所致。不过也有很多构建的蛋白酶缺陷型菌株表达重组蛋白效率不高,所以使用蛋白酶缺陷型的策略要慎重考虑。另外,这些菌株活性差,生长慢且难转化,Cereghino 和Cregg推荐只有在其他方法不能奏效时才考虑使用[84]。
1.2.2.3 蛋白质水平策略
通过将外源蛋白和蛋白水解酶抑制剂共同表达来抑制蛋白酶活性,减少目的蛋白降解,这种策略特别对蛋白酶降解敏感的重组蛋白有效。可将目的蛋白与一种在毕赤酵母中稳定的蛋白伴侣融合表达,通过改变目的蛋白的性质来提高稳定性[86];也可尝试将目的蛋白连上一个过氧化物酶体靶向信号(peroxisomal targetingsignal, PTS),使其被分拣转运入过氧化物酶体贮存起来,免受蛋白酶降解,还可减少对宿主细胞的毒害作用。总之,为了最大限度减少蛋白质的降解,通过将以上策略进行优化,使用以上一种或者几种培养策略可以高效的获得目的蛋白。高效控制目的蛋白的降解还需要权衡多方面的优化策略,甚至包括调节溶解氧、氨、添加维生素,脂肪酸等来降低蛋白酶的活性[74; 82; 87; 88]。其目的是不仅要得到目的蛋白最大产率或产量,同时也应获得目的蛋白天然生物活性形式[81]。
P. pastoris 可对分泌的蛋白进行O-接及N-连接的糖基化修饰。酵母的O-连接寡糖则由单一甘露糖残基组成。。O-糖基化的氨基酸顺序各不相同,在不同宿主中,O-连接寡糖可加在同一蛋白的不同残基上。真核细胞的N-连接糖基化均起始于内质网,即连接在脂质上的寡糖单位Glc3Man9 GlcNAc2 ( Glc 为葡萄糖, GlcNAc 为N2乙酰葡萄糖胺) 转移至Asn-X-Ser/ Thr 识别序列的天冬酰胺上。随后寡糖单位被剪切为Man8 GlcNAc2 。此时低等与高等真核细胞的N-连接糖基化模式开始分化。在高尔基体中,酵母通过增加甘露糖外链延长N-连接寡糖单位;哺乳动物则通过剪切和加成反应,产生3 种类型寡糖,包括Man5~6GlcNAc2组成的高甘露糖型,几种不同糖组成的混合型,或由两种糖组成的杂交型。虽然毕赤酵母分泌的外源蛋白糖基化相对较少,但在某些情况下,毕赤酵母也会分泌高糖基化的外源蛋白。