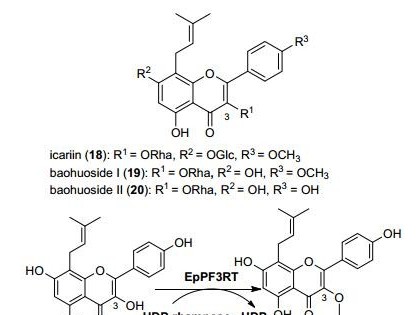
生物胺(Biogenic amines, BAs)是生物体内产生的一类低分子量含氮有机化合物的总称,是合成核酸、蛋白质、生物碱等的前体物质[1]。人体自身合成的生物胺可促进正常生理活动,而通过食物摄入过量生物胺会引起头疼、心悸、腹泻呕吐等不良反应,严重时可能危及生命[2-4]。生物胺的潜在毒性作用对人体健康构成的危害不容小觑,而发酵食品与发酵酒精饮料中普遍存在生物胺,因此应采取有效措施进行控制和减少[5-7]。
目前用于控制和减少发酵产品中的生物胺的方法,主要有对生产原料进行优化、减少发酵体系中产生物胺的微生物以及酶法降解这三种。前两种方法对加工设备的要求较高,很大可能会影响产品的风味,因此在实际生产中使用时存在一定的局限性[8]。利用酶法降解生物胺,基本不影响发酵食品生产工艺,对食品营养和风味的影响也较小[9-11]。已报道的可以降解生物胺的酶有胺氧化酶(Amine oxidases, AOs)、组胺脱氢酶(Histamine dehydrogenase, HADH)和多铜氧化酶(Multicopper oxidase, MCO)[12-14]。胺氧化酶和组胺脱氢酶只特异性作用于某个或某几个生物胺,它们的活性也分别受乙醇和羰基化合物的抑制,且最适pH多为中性,因此这两类酶的实际应用还存在较多问题[15]。多铜氧化酶催化生物胺氧化生成对应的醛、氨和水,从而达到分解生物胺的效果[16-19]。虽然现在已报道的多铜氧化酶能降解一种或多种生物胺[9, 20-21],但是尚缺少对这些多铜氧化酶酶学性质和应用特性的深入研究。
因此,寻找可用于降解发酵食品中生物胺的多铜氧化酶并对其酶学和应用特性进行研究,对于建立发酵食品中生物胺的酶法减控方法具有重要的意义。本研究旨在筛选获得具有降解生物胺能力的多铜氧化酶,并对其最适反应pH、温度等酶学性质及酶降解生物胺的能力进行探究。
1 材料与方法1.1 菌株与质粒本研究所用细菌菌株以及质粒均为本实验室保藏(表 1)。
| Name | Description | Source |
| Plasmids | ||
| pET28a | expression vector, kanR | Lab stock |
| pET28a-MCO | pET28a containing MCO | This work |
| Strains | ||
| Escherichia coli BL21(DE3) | expression host | Lab stock |
| E. coli BL21-pET28a-MCO | E. coli BL21 harboring pET28a-MCO | This work |
| Lactobacillus fermentum Y29 | Strain with capability of degradation of BA | Lab stock |
| Weissella cibaria 17 | Strain with capability of degradation of BA | Lab stock |
| Weissella paramesenteroides 30 | Strain with capability of degradation of BA | Lab stock |
| Weissella confuse 14 | Strain with capability of degradation of BA | Lab stock |
| Bacillus amyloliquefaciens XJ03 | Strain with capability of degradation of BA | Lab stock |
| Lactobacillus plantarum JP31 | Strain with capability of degradation of BA | Lab stock |
试剂:1, 7-二氨基庚烷、异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、质粒提取试剂盒购自生工生物工程(上海)股份有限公司;生物胺标准品购自美国Sigma公司;限制性内切酶、DNA聚合酶、DNA连接酶均为TaKaRa产品,其他试剂为分析纯试剂。
仪器:Gel Doc凝胶成像系统以及AKTA蛋白纯化仪购自美国Bio-Rad公司;安捷伦1260高效液相色谱(HPLC)购自美国安捷伦公司。
1.3 产生物胺降解酶菌株的筛选将分离自各类发酵食品中的6株细菌在MRS培养基中37 ℃静置培养20 h后,8 000 r/min离心10 min收集菌体并用无菌生理盐水洗涤菌体2次。将菌体以108 CFU/mL的浓度与酱油混匀37 ℃静置反应24 h。然后10 000 r/min离心5 min后取上清液,用HPLC测定生物胺的含量,比较各菌株的降解生物胺能力[22]。
1.4 多铜氧化酶的克隆表达与纯化1.4.1 表达多铜氧化酶重组菌的构建以发酵乳杆菌基因组为模板,用引物MCOF/MCOR (MCOF: 5'-CCGGAATTCATGAAA ACCTATACGGACTATTTC-3'; MCOR: 5'-CCCAA GCTTTTAGTGGTGGTGGTGATGATGCATTTTC ATCCCCATTT-3')扩增其多铜氧化酶基因,PCR产物和质粒pET28a均用EcoRⅠ和Hind Ⅲ进行双酶切和连接后,转化大肠杆菌JM109。提取含有正确序列转化子的重组质粒,转化大肠杆菌BL21,构建的表达多铜氧化酶的重组菌命名为E. coli BL21- pET28a-MCO。
1.4.2 重组多铜氧化酶的表达与纯化重组菌用LB培养基(含50 mg/L卡那霉素) 37 ℃、220 r/min培养过夜。然后按1% (V/V)转接至TB培养基(含50 mg/L卡那霉素),37 ℃、220 r/min培养至OD600为0.6-0.8,加入1 mmol/L的Cu2+和0.1 mmol/L IPTG,在20 ℃培养20 h。
菌液于4 ℃、8 000 r/min离心5 min后收集菌体,用20 mmol/L磷酸盐缓冲液PBS (pH 7.4)洗涤菌体2次后重悬菌体,再进行超声破碎。离心(4 ℃,12 000 r/min,20 min)收集上清制得多铜氧化酶粗酶液。重组多铜氧化酶的纯化采用镍柱纯化,用0.5 mol/L咪唑溶液(pH 7.4)进行梯度洗脱,收集有活性的组分进行脱盐处理后用于后续分析和研究。
1.5 多铜氧化酶活力测定采用可见光吸收法测定多铜氧化酶活力[20]:即以2, 2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)为底物,通过检测酶氧化ABTS的量计算多铜氧化酶酶活。反应时间为2 min,反应体系为100 µL酶液、2.9 mL含0.5 mmol/L ABTS和1 mmol/L CuCl2的柠檬酸钠缓冲液。将每分钟氧化1 µmol ABTS所需的酶量定义为一个酶活力单位(U)。酶活计算公式如下所示:
 |
式中:ε为ABTS在420 nm下的摩尔吸光系数,ε=3.6×104 L/(mol·cm);Δt为反应时间(min);ΔOD为420 nm处吸光度的变化值;V1为反应总体积(mL);V2为酶量(100 µL)。
1.6 重组多铜氧化酶酶学性质研究1.6.1 重组酶的最适反应温度及pH测定酶的最适反应温度和pH时,除了反应温度和pH外,其他条件与测定多铜氧化酶酶活的反应条件相同。考察温度为25-70 ℃,pH为2.5-5.0 (50 mmol/L乙酸钠缓冲液),5.5-7.0 (50 mmol/L PBS缓冲液),7.5-8.5 (50 mmol/L Tris-HCl缓冲液)。
1.6.2 金属离子和盐对重组多铜氧化酶酶活的影响金属离子对酶活的影响:将酶液与1 mmol/L的金属离子缓冲液混合,保温10 min后测定酶活力,以未加金属离子的为对照。
NaCl对重组多铜氧化酶稳定性的影响:将酶液在含有10%、15%、18%和20% (W/V)的NaCl缓冲液中放置1 h后测定酶活力,以未加NaCl的为对照。
1.6.3 酶反应动力学参数测定在最适反应条件下,分别测定体系中含有0.1-1.0 mmol/L ABTS时的酶活,根据Lineweaver- Burk双倒数作图法计算得到重组多铜氧化酶的Km、Vmax值。
1.6.4 重组多铜氧化酶对单个生物胺的降解能力分析将100 U/L多铜氧化酶分别与浓度为50 mg/L的组胺、酪胺、尸胺、腐胺、色胺、苯乙胺、精胺和亚精胺溶液混合,于37 ℃静置48 h后测定生物胺的含量,对照组为不加酶的生物胺溶液,分析重组多铜氧化酶对不同底物的降解能力。
1.7 重组多铜氧化酶对混合生物胺的降解将500 U/L多铜氧化酶分别加入生物胺溶液和市售酱油中,于37 ℃静置24 h后测定生物胺的含量,对照组为不加酶的生物胺溶液或市售酱油。生物胺溶液中各生物胺的浓度依据市售酱油中生物胺含量配置,其组成为:色胺20 mg/L,腐胺、尸胺和亚精胺50 mg/L,苯乙胺150 mg/L,组胺和酪胺200 mg/L。
2 结果与分析2.1 降生物胺菌株的选择为了筛选一种可以用于降解发酵食品中生物胺的酶,本研究考察了6株来源于发酵食品的细菌降解酱油中生物胺的能力。由图 1可以看出,发酵乳杆菌对总胺的降解率最高,为16.1%;此外,它对酪胺、组胺的降解作用最强,降解率分别为23.0%和10.0%。发酵食品中酪胺和组胺含量相对比较高,而且组胺由于其危害性较大是食品中限量规定的代表性生物胺[23]。在考察的6株细菌中,发酵乳杆菌是最具降解发酵食品中生物胺潜力的菌株。因此,选择它用于生物胺降解酶的相关研究。
 |
| 图 1 菌株降解酱油中生物胺能力的比较Fig. 1 Comparison of degradation of biogenic amines in soy source by microbial strains |
|
图选项
|
通过在NCBI数据库中寻找发酵乳杆菌基因组中编码多铜氧化酶基因的同源序列,设计了用于扩增的引物(MCOR和MCOF)。以发酵乳杆菌Y29基因组DNA为模板,成功扩增了发酵乳杆菌Y29基因组中编码多铜氧化酶的基因(图 2)。将此PCR产物与载体pET28a经酶切连接后,转化大肠杆菌,成功构建了表达重组多铜氧化酶的E. coli BL21 pET28a-MCO。
 |
| 图 2 发酵乳杆菌Y29中编码多铜氧化酶基因的扩增Fig. 2 Amplification of gene encoding multicopper oxidase in the genome of L. fermentumY29. M: marker; 1: negative control; 2: amplification of gene encoding multicopper oxidase |
|
图选项
|
重组菌E. coli BL21 pET28a-MCO表达重组多铜氧化酶的情况见图 3A。经测定,重组多铜氧化酶在大肠杆菌中的表达水平为484 U/L,其分子量约为58 kDa。将此粗酶液通过镍柱亲和层析,得到了重组多铜氧化酶纯酶(图 3B)。
 |
| 图 3 重组多铜氧化酶的表达与纯化Fig. 3 expression and purification of recombinant MCO. (A) expression of MCO in E. coli BL21. M: marker; 1–2: insoluble and soluble fractions of E. coli BL21 pET28a; 3–4: insoluble and soluble fractions of E. coli BL21 pET28a-MCO. (B) Purification of MCO. 1: purified MCO |
|
图选项
|
通过考察发现,重组多铜氧化酶的最适反应pH为3.5,当反应pH为3.0–4.5时,酶的活性大于50% (图 4A)。该重组多铜氧化酶的最适反应pH值与植物乳杆菌Lactobacillus plantarum来源的多铜氧化酶相同[21],而来源于地衣芽孢杆菌Bacillus licheniformis和假单胞菌Pseudomonas sp. 593的多铜氧化酶最适反应pH则略高[24-25]。对来源于发酵乳杆菌的MCO的最适反应pH研究表明,该MCO为酸性酶,因此具有应用于发酵食品的潜力。
 |
| 图 4 重组多铜氧化酶的最适反应pH和温度Fig. 4 Detection of the optimal pH (A) and temperature (B) of the recombinant MCO for enzymatic reaction |
|
图选项
|
由图 4B可知,重组多铜氧化酶的最适反应温度为50 ℃,50 ℃时重组酶的活性是30 ℃时的1.7倍。
2.3.2 金属离子和盐对多铜氧化酶酶活的影响由于金属离子与多铜氧化酶的催化氧化反应之间有一定关系,因此本研究考察了金属离子对重组多铜氧化酶酶活的影响。由图 5A可知,Cu2+、Ni2+和Mg2+对重组多铜氧化酶均有激活作用,其中Cu2+对重组多铜氧化酶的激活作用最大,使酶活提高了1.89倍。Cu2+对重组多铜氧化酶的激活作用,可能与多铜氧化酶含有4个铜离子结合位点相关[26]。Mn2+、Zn2+和Fe2+对酶有抑制作用,Fe2+对酶活的抑制作用最明显,在其存在下酶活仅为对照的57.7%。
 |
| 图 5 金属离子和NaCl对重组多铜氧化酶酶活的影响Fig. 5 Effect of mental ions and NaCl on activity of recombinant MCO |
|
图选项
|
酱油是一个高盐食品体系,NaCl浓度约为18% (W/V)。考察多铜氧化酶对盐的耐受性,有助于为该酶在高盐发酵食品中的应用提供参考。由图 5B可以看出,重组多铜氧化酶在NaCl存在的条件下,酶活均受到一定程度的抑制,但在18% (W/V) NaCl中其活性仍有39.3%。该重组酶与漆酶同属于多铜氧化酶家族,漆酶在低pH环境中酶活受到阴离子的抑制同时可以被NaCl激活,因此10%与15%的NaCl对酶活的抑制高于18%的NaCl,可能与pH和NaCl对酶的协同作用相关[27-29]。
2.3.3 多铜氧化酶反应动力学参数测定以ABTS为底物,通过测定最适反应条件下反应体系中含有不同浓度底物时的酶活性,得到用于分析MCO酶反应动力学参数的Lineweaver-Burk双倒数图(图 6)。由图 6求得的重组发酵乳杆菌MCO的Km值为1.3 mmol/L,Vmax为7.67×10–2 mmol/(L·min)。该重组多铜氧化酶的Km低于克雷白氏杆菌Klebsiella sp.来源的多铜氧化酶(Km=5.63 mmol/(L·min))[26],略高于苍白杆菌Ochrobactrum sp.来源的多铜氧化酶(Km=0.072 mmol/(L·min))[30]。
 |
| 图 6 双倒数作图法测定MCO酶反应动力学参数Fig. 6 Analysis of enzyme kinetics of MCO by Lineweaver-Burk plotting |
|
图选项
|
为研究重组多铜氧化酶可降解生物胺的种类和能力,考察了重组多铜氧化酶对单个生物胺的降解情况。由图 7可以看出,除精胺外,重组多铜氧化酶对考察的8种生物胺中的7种生物胺均有降解效果。其中对组胺、酪胺、腐胺、亚精胺的降解效果最显著,分别降低了51.6%、40.9%、40.7%和38.2%。与来源于植物乳杆菌Lactobacillus plantarum的多铜氧化酶和来源于金黄节杆菌Arthrobacter aurescens的胺氧化酶相比[13],该重组酶降解组胺、酪胺的能力高,且降解谱广。
 |
| 图 7 重组多铜氧化酶对单个生物胺的降解Fig. 7 Degradation of individual biogenic amine by MCO |
|
图选项
|
为进一步揭示来源于发酵乳杆菌Y29的多铜氧化酶降解生物胺的能力,考察了其在对混合生物胺溶液(根据市售酱油中各类生物胺的含量范围配置,生物胺总量为(720±15 mg/L)和市售酱油中生物胺的降解效果。在混合生物胺体系中,多铜氧化酶可以降解除精胺外的色胺、尸胺、苯乙胺、腐胺、酪胺、亚精胺和组胺7种生物胺,其中对组胺的降解率最高,达到81.5%,对总胺的降解率为41.7% (图 8A)。与来源于Lactobacillus plantarum J16和乳酸片球菌Pediococcus acidilactici CECT 5930的多铜氧化酶相比,该重组酶降解组胺的能力高,且降解谱广,来源于Lactobacillus plantarum J16的多铜氧化酶对组胺的降解率为36%且仅能降解3种生物胺,来源于Pediococcus acidilactici CECT 5930的多铜氧化酶不能降解组胺且仅能降解酪胺这一种生物胺[21, 31]。由图 8B可以看出,本研究所用市售酱油中生物胺总量为881±13 mg/L,多铜氧化酶在此体系中可以降解除精胺外的7种生物胺,它对组胺和酪胺的降解效果较好,降解率分别为11.3%和6.8%,对总胺的降解率为10.6% (图 8B)。目前尚未有关于重组多铜氧化酶应用于酱油降解生物胺的报道,但Rosa Guarcell等的研究表明Lactobacillus paracasei CB9CT、副干酪乳杆菌Lactobacillus paracasei CACIO6CT、戊糖片球菌Pediococcus pentosaceus M1能降解奶酪中生物胺都与其含有多铜氧化酶相关,因此本研究的重组多铜氧化酶具备降解发酵食品中生物胺的应用潜力[32]。
 |
| 图 8 重组多铜氧化酶对混合生物胺和酱油中生物胺的降解Fig. 8 Degradation of biogenic amines in mixed biogenic amines solution (A) or soy sauce (B) by MCO |
|
图选项
|
利用生物酶法减少发酵食品中的生物胺是目前控制食品中生物胺最有前景的途径。但目前用于降解生物胺的酶种类少、降解谱窄、降解率低,尚不能满足实际应用的需求。本研究通过分析来源于发酵乳杆菌的多铜氧化酶的酶学性质以及降解生物胺能力发现,该重组多铜氧化酶可降解包括色胺、尸胺、苯乙胺、腐胺、酪胺、亚精胺和组胺在内的7种生物胺,并且可显著降低酱油中含量最高的两种生物胺[33]——组胺和酪胺。此重组多铜氧化酶为酸性酶,对18%的NaCl有一定的耐受性,在高温50 ℃时酶的催化活性显著提高。此外,该多铜氧化酶具有降解酱油中生物胺的能力,对总胺降解率达到了10.6%。本研究初步评估了来源于发酵乳杆菌的多铜氧化酶在发酵食品体系中降解生物胺的能力,今后通过构建酶的食品级表达体系以及优化提高酶的表达水平,有望进一步挖掘多铜氧化酶在降解发酵食品中生物胺的应用潜力,为进一步实现这类食品酶的实际应用奠定基础。
| [1] | Shalaby AR. Significance of biogenic amines to food safety and human health. Meat Res, 2005, 29(7): 675–690. |
| [2] | Feng TT, Fang F, Yang J, et al. Formation and removal of biogenic amines in food bioprocessing. Food Sci, 2013, 34(19): 360–366. (in Chinese). 冯婷婷, 方芳, 杨娟, 等. 食品生物制造过程中生物胺的形成与消除. 食品科学, 2013, 34(19): 360-366.DOI:10.7506/spkx1002-6630-201319074 |
| [3] | Shah P, Swiatlo E. A multifaceted role for polyamines in bacterial pathogens. Mol Microbiol, 2008, 68(1): 4–16. DOI: 10.1111/j.1365-2958.2008.06126.x |
| [4] | Tofalo R, Perpetuini G, Schirone M, et al. Biogenic amines: toxicology and health effect. Enc Food Heal, 2016: 424–429.DOI: 10.1016/B978-0-12-384947-2.00071-4 |
| [5] | Kim MK, Mah JH, Hwang HJ. Biogenic amine formation and bacterial contribution in fish, squid and shellfish. Food Chem, 2009, 116(1): 87–95. DOI: 10.1016/j.foodchem.2009.02.010 |
| [6] | Zou Y. Study on formation mechanism and control of biogenic amines during the process of high-salt diluted soy sauce[D]. Guangzhou: South China University of Technology, 2012 (in Chinese). 邹阳.高盐稀态酱油生产过程中生物胺的形成机制及发酵调控研究[D].广州: 华南理工大学, 2012.http://cdmd.cnki.com.cn/Article/CDMD-10561-1012451481.htm |
| [7] | Koral S, Tufan B, Ščavničar A, et al. Investigation of the contents of biogenic amines and some food safety parameters of various commercially salted fish products. Food Contr, 2013, 32(2): 597–606. |
| [8] | Yang LK, Fu XJ, Hu YB, et al. Screening of strains with degradation activity for biogenic amines in fish sauce. Food Sci, 2012, 33(11): 158–162. (in Chinese). 杨利昆, 付湘晋, 胡叶碧, 等. 鱼露中生物胺降解菌的筛选及其特性. 食品科学, 2012, 33(11): 158-162. |
| [9] | Callejon S, Sendra R, Ferrer S, et al. Recombinant laccase from Pediococcus acidilactici CECT 5930 with ability to degrade tyramine. PLoS ONE, 2017, 12(10): e0186019. DOI: 10.1371/journal.pone.0186019 |
| [10] | Callejón S, Sendra R, Ferrer S, et al. Identification of a novel enzymatic activity from lactic acid bacteria able to degrade biogenic amines in wine. Appl Microbiol Biotechnol, 2014, 98(1): 185–198. DOI: 10.1007/s00253-013-4829-6 |
| [11] | Fadda S, Vignolo G, Oliver G. Tyramine degradation and tyramine/histamine production by lactic acid bacteria and Kocuria strains. Biotechnol Lett, 2001, 23(24): 2015–2019. DOI: 10.1023/A:1013783030276 |
| [12] | Dapkevicius MLNE, Nout MJR, Rombouts FM, et al. Biogenic amine formation and degradation by potential fish silage starter microorganisms. Int J Food Microbiol, 2000, 57(1/2): 107–114. |
| [13] | Lee JI, Kim YW. Characterization of amine oxidases from Arthrobacter aurescens and application for determination of biogenic amines. World J Microbiol Biotechnol, 2013, 29(4): 673–682. DOI: 10.1007/s11274-012-1223-y |
| [14] | Siddiqui JA, Shoeb SM, Takayama S, et al. Purification and characterization of histamine dehydrogenase from Nocardioides simplex IFO 12069. FEMS Microbiol Lett, 2000, 189(2): 183–187. DOI: 10.1111/fml.2000.189.issue-2 |
| [15] | Sattler J, Hesterberg R, Lorenz W, et al. Inhibition of human and canine diamine oxidase by drugs used in an intensive care unit: relevance for clinical side effects. Agents Actions, 1985, 16(3/4): 91–94. |
| [16] | Hoegger PJ, Kilaru S, James TY, et al. Phylogenetic comparison and classification of laccase and related multicopper oxidase protein sequences. FEBS J, 2006, 273(10): 2308–2326. DOI: 10.1111/ejb.2006.273.issue-10 |
| [17] | Askwith C, Eide D, van Ho A, et al. The FET3 gene of S. cerevisiae encodes a multicopper oxidase required for ferrous iron uptake. Cell, 1994, 76(2): 403–410. DOI: 10.1016/0092-8674(94)90346-8 |
| [18] | Madhavi V, Lele SS. Laccase: properties and applications. Bioresources, 2009, 4(4): 1694–1717. |
| [19] | Solomon EI, Sundaram UM, Machonkin TE. Multicopper oxidases and oxygenases. Chem Rev, 1996, 96(7): 2563–2606.DOI: 10.1021/cr950046o |
| [20] | Sheng Y, Yan L, Hong Y, et al. Gene cloning, identification, and characterization of the multicopper oxidase CumA from Pseudomonas sp. 593. Biotechnol Appl Biochem, 2017, 64(3): 345–355. |
| [21] | Callejón S, Sendra R, Ferrer S, et al. Cloning and characterization of a new laccase from Lactobacillus plantarum J16CECT 8944 catalyzing biogenic amines degradation. Appl Microbiol Biotechnol, 2016, 100(7): 3113–3124. DOI: 10.1007/s00253-015-7158-0 |
| [22] | Li ZJ. Methods for determination of genetic amines in food and amine-producing bacteria and its application[D]. Qingdao: Ocean University of China, 2007 (in Chinese). 李志军.食品中生物胺及其产生菌株检测方法研究[D].青岛: 中国海洋大学, 2007. |
| [23] | Del Rio B, Redruello B, Linares DM, et al. The dietary biogenic amines tyramine and histamine show synergistic toxicity towards intestinal cells in culture. Food Chem, 2017, 218: 249–255. DOI: 10.1016/j.foodchem.2016.09.046 |
| [24] | Koschorreck K, Richter SM, Ene AB, et al. Cloning and characterization of a new laccase from Bacillus licheniformiscatalyzing dimerization of phenolic acids. Appl Microbiol Biotechnol, 2008, 79(2): 217–224. DOI: 10.1007/s00253-008-1417-2 |
| [25] | Yang S, Long Y, Yan H, et al. Gene cloning, identification, and characterization of the multicopper oxidase CumA from Pseudomonas sp. 593. Appl Microbiol Biotechnol, 2017, 64(3): 345–355. |
| [26] | Li Y, Yin J, Qu G, et al. Gene cloning, protein purification, and enzymatic properties of multicopper oxidase, from Klebsiellasp. 601. Can J Microbiol, 2008, 54(9): 725–733. DOI: 10.1139/W08-063 |
| [27] | Brander S, Mikkelsen JD, Kepp KP. Characterization of an alkali- and halide-resistant laccase expressed in E. coli: CotA from Bacillus clausii. PLoS ONE, 2014, 9(6): e99402. DOI: 10.1371/journal.pone.0099402 |
| [28] | Kunamneni A, Plou FJ, Ballesteros A, et al. Laccases and their applications: a patent review. Recent Pat Biotechnol, 2008, 2(1): 10–24. DOI: 10.2174/187220808783330965 |
| [29] | Ruijssenaars HJ, Hartmans S. A cloned Bacillus halodurans multicopper oxidase exhibiting alkaline laccase activity. Appl Microbiol Biotechnol, 2004, 65(2): 177–182. |
| [30] | Yang L, Zuo WF, Li YD, et al. Cloning of multicopper oxidase gene from Ochrobactrum sp. 531 and characterization of its alkaline laccase activity towards phenolic substrates. Adv Biol Chem, 2012, 2(3): 248–255. DOI: 10.4236/abc.2012.23031 |
| [31] | Callejón S, Sendra R, Ferrer S, et al. Recombinant laccase from Pediococcus acidilactici CECT 5930 with ability to degrade tyramine. PLoS ONE, 2017, 12(10): e0186019. DOI: 10.1371/journal.pone.0186019 |
| [32] | Guarcello R, De Angelis M, Settanni L, et al. Selection of amine-oxidizing dairy lactic acid bacteria and identification of the enzyme and gene involved in the decrease of biogenic amines. Appl Environ Microbiol, 2016, 82(23): 6870–6880. DOI: 10.1128/AEM.01051-16 |
| [33] | Yu JZ, Xu F, Xu Y. Analysis on the change rule of biogenic amines during the process of high-salt diluted soy sauce. Food Fermn Ind, 2016, 42(10): 44–49. (in Chinese). 于金芝, 徐峰, 徐莹. 高盐稀态酱油生产过程中的生物胺变化规律. 食品与发酵工业, 2016, 42(10): 44-49. |