仇申珅1,2,丁娟娟1,2,曲淑玲3,张轶群3,陆海燕1,2,邹少兰1,2*
1(天津大学 化工学院,天津,300350)2(系统生物工程教育部重点实验室,天津,300350) 3(中国石油大港油田团泊洼开发公司,天津,301607)
摘 要 利用已有一定胞外cAMP生产能力的酿酒酵母基因工程菌株G2,考察影响其生长和发酵生产胞外cAMP的关键工艺参数,进行初步的发酵工艺优化,为下一步的菌种改造和发酵过程优化奠定基础。结果表明,葡萄糖和酵母粉、蛋白胨含量及其配比是本研究考察参数中影响最大的因素,100 g/L葡萄糖和20 g/L酵母粉、40 g/L蛋白胨(简称为2*YP)培养基发酵的最大cAMP浓度可以达到(4 311.2±308.3) μmol/L,为100 g/L葡萄糖和10 g/L酵母粉、20 g/L蛋白胨(简称为1*YP)含量下最大值(1 972.0±122.5) μmol/L的2.186倍;添加前体物腺嘌呤(终质量浓度0.625 g/L)到前述2种培养基中可以进一步提高产量,分别达到(4 678.1±238.6)、(3 387.3±277.8) μmol/L,增幅分别为8.5%和71.8%;添加前体物次黄嘌呤到100 g/L葡萄糖和1*YP培养基中提高产量6.65%。
关键词 酿酒酵母;环磷酸腺苷;发酵;工艺优化;腺嘌呤
环式3’,5’-单磷酸腺嘌呤核苷(3’,5’-cyclic adenosine monophosphate,cAMP),简称环磷酸腺苷,是普遍存在于生物机体内并在生物机体的功能调节中起着重要作用的生理活性物质,被称为第二信使[1]。基于cAMP的特殊作用和地位,cAMP一方面被作为重要的心血管系统药物长期用于临床治疗[2-3],一方面被证明在动物生产领域也有极大的潜在应用价值[4]。
目前已知临床用cAMP均来自化学法合成法[5]。此法原料受限,存在较为严重的环境污染问题。相比之下,发酵法具有可实现持续生产、工艺简单、能利用廉价的碳源、毒副作用小等多种优势。而酿酒酵母(Saccharomycescerevisiae)不仅具有工业化应用技术成熟、抗逆性强、为食品安全性GRAS微生物的优点,同时作为最早实现全基因组测序的微生物菌种,又是分子生物学和遗传学研究的最重要模式生物之一[6]。因此,通过遗传工程手段的改造实现以酿酒酵母为菌种的cAMP发酵法生产,预测会具有特殊的优势。
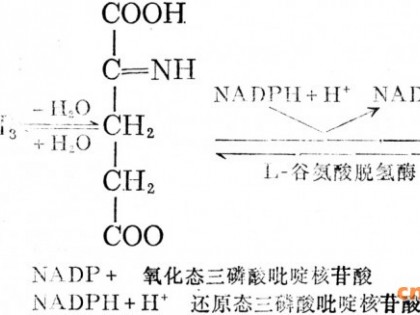
酿酒酵母胞内嘌呤核苷酸的合成途径有从头合成途径(de novo synthesis)和补救途径(salvage pathway),见图1。在从头合成途径中,以PRPP为前体物经过一系列酶促反应生成IMP进而生成AMP和GMP;同时,在补救途径中,培养基中的次黄嘌呤(hypoxanthine)、腺嘌呤(adenine)或鸟嘌呤(guanine)被细胞运输到胞内,分别直接参与合成IMP、AMP或GMP。研究证明酵母嘌呤核苷酸代谢的调控机制极为复杂[1,7-8],上述前体物的胞外供应情况也直接影响胞内2个途径之间的协同、平衡。而cAMP通过cAMP-PKA信号转导途径发挥第二信使作用,其在细胞内的含量水平(涉及合成与降解过程)更受到极为严谨、精细、协同、及时的调控[9]。激发酵母中cAMP合成的一大刺激源是胞外葡萄糖和蔗糖含量水平[9];另一方面如图1所示,嘌呤核苷酸合成所需的起始原料5’-磷酸核糖(5-P-Ribose)经EMP和HMP途径生成,嘌呤核苷酸合成所需的还原力和大量能量(ATP)主要由TCA提供(图1)[10],因此,EMP、HMP和TCA循环代谢流水平也必然影响到胞内cAMP合成水平。
作为最重要的模式生物之一,酿酒酵母cAMP相关基础研究—以cAMP-PKA信号转导途径为核心的、被cAMP调控和调控cAMP的途径及其机制研究非常多,发表论文数以千计,但将其用于发酵生产cAMP则未见报道[1,7-9]。本课题组成员进行了大量有关酿酒酵母cAMP-PKA信号转导通路的研究,构建得到一系列不同基因修饰、不同遗传背景的菌株,并首先关注到酿酒酵母可以大量积累胞外cAMP,进而比较系统地研究胞外cAMP浓度的影响因素和变化规律[8,11-12]。已有代谢工程研究证明:细胞途径的修饰(合成)→修饰后细胞表型的严格评价(表型表征)→根据评价结果设计进一步的修饰(优化设计),是一个不断循环和递进的菌种改进与生物过程整体优化的过程[13]。本研究拟基于图1所示代谢途径网络和相关代谢调控机制的分析,初步评价酿酒酵母工程菌株发酵生产胞外cAMP的能力及其关键影响因素,尝试考察通过优化发酵条件而调控代谢流、进一步提高cAMP产量的潜力,为下一步的菌株改造、发酵过程优化和最终充分发挥酿酒酵母平台cAMP生产潜力打下基础。

图1 酿酒酵母嘌呤代谢及cAMP合成途径
Fig.1 Purine metabolism and cAMP synthesis pathway in Saccharomyces cerevisiae
G2为本室前期工作中构建的、已证明有一定胞外cAMP生产能力的酿酒酵母基因修饰工程菌株[11]。
1. 2 培养基及培养条件
YPD培养基(g/L):酵母抽提物10,蛋白胨20,D-葡萄糖20,固体培养基则还需添加琼脂粉15。酵母菌株活化和种子液培养:固体培养为30 ℃培养箱倒置2~3 d至菌落生长至合适大小;液体培养为30 ℃、190 r/min过夜。
发酵培养基(g/L):一般情况下为酵母提取物10,蛋白胨20,葡萄糖20~100,自然pH值。需要时在发酵培养基中添加其他组分如前体物次黄嘌呤、腺嘌呤。发酵条件:一般情况下为30 ℃、190 r/min、72~168 h。
1. 3 发酵评价
种子液培养:挑取固体培养基平板上生长的菌落,接入装有5 mL YPD培养液的试管中,30 ℃下190 r/min过夜培养,然后转接进行二次扩大培养,所得菌液用作种子液。
发酵培养:上述新鲜种子液接种到装有25 mL发酵培养基的100 mL三角瓶中,控制初始OD600值在0.3左右,30 ℃、190 r/min下发酵,间隔12或24 h取样进行分析。
发酵液的分析:1.OD600测定:将发酵样品适当稀释后测定OD600,检测生长情况;2.HPLC分析胞外cAMP和腺嘌呤浓度:将发酵样品在13 000 r/min、2 min条件下离心,取上清液进行适当稀释,用孔径0.22 μm的滤膜过滤,滤液用于色谱检测:美国Waters公司Waters Alliance2695高效液相色谱仪,检测波长258 nm,Thermo Syncronis C18色谱柱,流动相组分为:(5.78 g/L KH2PO4,2.72 g/L四丁基溴化铵,用磷酸调节pH值至4.3)∶乙腈=85∶15,流速1 mL/min,柱温35℃;3.HPLC分析葡萄糖和乙醇质量浓度:发酵样品的处理同前,色谱检测条件为:安捷伦公司示差检测器,Bio-Rad公司Aminex HPX-87H柱,流动相为4 mmol/L H2SO4,流速为0.4 mL/min,柱温40 ℃。
2 结果与分析
如前言所述,包括cAMP在内的嘌呤核苷酸合成要消耗大量能量,因此足量的供氧和溶氧是必需的;cAMP的特殊地位决定了它的活跃合成和分泌必需有足量的、高活性的细胞生成,而大量前期工作也证明了较高水平的胞外cAMP生产是以一定的生物量积累为前提,菌体生长不佳时,胞外cAMP水平必然低;对比分析cAMP的分子式C10H12N5O6P和酿酒酵母菌体有机成分含量(碳46%~52%,氮6.0%~8.5%),要同时满足生物量合成和cAMP合成的需要,培养基碳氮比的控制是必要和关键的;葡萄糖是经cAMP-PKA途径刺激cAMP合成的刺激源,葡萄糖浓度效应也有待观察。
因此,本研究以酿酒酵母常用的培养基YPD(酵母粉10 g/L,蛋白胨20 g/L,D-葡萄糖20 g/L)和好氧培养条件30 ℃、190 r/min为基础,首先考察葡萄糖浓度对工程菌株生长和发酵产生胞外cAMP的影响。
2. 1 葡萄糖对G2菌株生长和生产胞外cAMP的影响
结果见图2。由图2可知:100、50 g/L葡萄糖下的生长彼此没有明显差异,最大OD600值分别为48.25(96 h)和49.60(96 h),而20 g/L葡萄糖下最大OD600值为33.35(48 h);与生长相应,20 g/L葡萄糖下48 h达到cAMP浓度最大值(935.3 μmol/L),100、50 g/L葡萄糖下cAMP生产都在48~72 h时表现出停顿,至96 h继续上升(浓度分别为1 942.0、1 526.8 μmol/L);50、20 g/L葡萄糖摇瓶发酵都在24 h基本耗尽葡萄糖的同时,乙醇浓度达到最大(1.817、0.568 g/L),而100 g/L葡萄糖发酵则在96 h时仍有1.498 g/L的残糖,乙醇质量浓度在48 h达最大值1.808 g/L,后下降。

图2 不同葡萄糖浓度下的生长(A)、CAMP浓度(B)、葡萄糖浓度(C)和乙醇浓度(D)曲线
Fig.2 The growth(A), cAMP(B), glucose(C) and ethanol(D) curves at different glucose concentrations
这些结果初步暗示了细胞生长与cAMP生产既相互关联又相对独立的复杂关系;大量副产物乙醇的产生也必然消耗碳源、降低底物转化率。
需要说明的是:在上述条件下,作为对照设置的实验室菌株W303-1A发酵液的胞外cAMP有时检测不到,有时低至1~3 μmol/L。
2. 2 接种方式对G2菌株生产胞外cAMP的影响
由2.1结果可知:YPD培养基、30 ℃、190 r/min下的种子液培养亦会产生较高水平的胞外cAMP。为考察发酵体系起始cAMP水平对发酵的影响,兼顾观察种子液残余培养基成分的影响,设置了2种方式接种:种子液直接接种和种子液先离心收集细胞再用无菌水重悬接种。结果见表1,发酵葡萄糖质量浓度为100 g/L,其余发酵条件同前。结果显示二者没有明显差异。
2. 3 次黄嘌呤对G2菌株生产cAMP的影响
根据图1所示代谢途径,考察了添加前体物次黄嘌呤的效果。次黄嘌呤溶解度低,设计的最大添加量2 g/L。结果见表2。发酵葡萄糖质量浓度为100 g/L,其余发酵条件同前。
表1接种方式对菌株生长和发酵的影响
Table1Effectofinoculationmethodonstraingrowthandfermentation

表2结果表明次黄嘌呤对菌株生长基本没有影响的同时,仅能有限地提高cAMP产量。
2. 4 腺嘌呤和酵母粉/ 蛋白胨含量对G2菌株生产cAMP的影响
与次黄嘌呤不同,预实验证明腺嘌呤有明显的提高cAMP产量的效果;但浓度过高的情况下,会明显抑制生长从而最终影响到cAMP产量,同时发酵结束时会有大量腺嘌呤剩余、不能被利用,增加了发酵成本。另一方面,对比图2中100和50 g/L葡萄糖下的生长和发酵情况,分析酵母粉、蛋白胨相对于葡萄糖含量偏低构成了100 g/L葡萄糖下生长与发酵的制约。因此,这里同时考察添加腺嘌呤和提高酵母粉、蛋白胨含量的效果:1.根据预实验结果,确定腺嘌呤的添加量为0.625 g/L(在图3中标注为A 0.625);2.将前面实验采用的10 g/L酵母粉、20 g/L蛋白胨含量简称为1*YP,将含量翻倍后的20 g/L酵母粉、40 g/L蛋白胨含量简称为2*YP。结果见图3和表3。
表2次黄嘌呤对菌株生长和发酵的影响
Table2Theeffectsofhypoxanthineonthegrowthandfermentation


图3 腺嘌呤和1*YP或2*YP中的生长(A)和发酵(B)曲线
Fig.3 The growth(A) and fermentation(B) curves in the media with adenine and 1*YP or 2*YP
表3腺嘌呤和酵母粉/蛋白胨含量对菌株生长和发酵的影响
Table3Theeffectofadenineandyeastextract/peptoneonthegrowthandfermentation

由图3和表3可知:维持100 g/L葡萄糖质量浓度不变的情况下,将酵母粉、蛋白胨含量加倍能将cAMP浓度提高到4 311.2 μmol/L,为对照的2.186倍;在此基础上添加腺嘌呤能继续提高产量8.5%,但远远低于1*YP培养基中添加腺嘌呤的增产效果(71.8%);添加0.625 g/L腺嘌呤仍然表现出了轻微的生长抑制;生长和cAMP产量之间仍然表现出既相互关联又相对独立的复杂关系。
3 讨论
如前言所述,cAMP在胞内的含量受到极为严格的控制。在基因修饰调控相关代谢及其调节机制的情况下,提供菌株良好的环境条件、考察和优化生长和发酵工艺参数,是进一步提高目的产物产量、充分发挥其生产潜能的必需和重要的一环,也是下一轮菌种改造和发酵优化的基础。本研究基于文献报道(图1)代谢途径及其调控机制研究,以及实验室前期工作基础,将工作重点放在培养基组分上,选择碳源葡萄糖、氮源酵母粉/蛋白胨和前体物次黄嘌呤/腺嘌呤进行生长和发酵观察。实验结果一方面证实了优化碳氮比的显著效果,一方面暗示了细胞生长与cAMP发酵之间存在着复杂的联系;前体物腺嘌呤添加到1*YP和2*YP培养基中增产效应上的显著差异,推测是嘌呤合成2种途径——从头合成途径和补救途径之间平衡因碳氮比和碳氮比所至菌体生长差异而变化的反映。
因此,下一步的工作有必要通过正交设计深入考察葡萄糖、酵母粉、蛋白胨和腺嘌呤之间在糖耗-生长-cAMP发酵-乙醇产生关系上更为精细、全面的相互作用,在此基础上增加溶氧和代谢流分析,以更深入了解发酵过程调控和优化最核心的问题之一——实施生长与cAMP发酵分阶段控制的必要性、可能临界点和敏感参数。
另一方面,本工作虽然是发酵工艺部分参数的初步优化考察,但结果已经清楚显示出了酵母与其他微生物(尤其是细菌)在cAMP代谢及其调控、生产优化措施上的显著差别[1,9,14-16]。添加次黄嘌呤前体物可将节杆菌cAMP产量从0.43 g/L提高到4.08 g/L,效应极为显著[15];其他对节杆菌增产有效的措施(包括添加腺嘌呤前体物)[15],在本研究中则观察到效果有较大的出入(部分结果没有显示)。事实上,对cAMP信号通路及其调控机制认识、研究的程度制约着对它的利用水平。作为最重要的模式生物之一,酿酒酵母cAMP相关研究一直未曾间断过[7,9,17-19];而细菌到目前为止还没有被发现有类似酵母cAMP-PKA信号转导途径中依赖于cAMP的蛋白质激酶PKA[1,16]。本研究首次报道了酿酒酵母生产cAMP发酵工艺的初步优化,结果一方面如前提供了进行下一步工作的线索,另一方面则进一步提示了在迄今为止对生物cAMP代谢途径网络和相关代谢调控机制认识基础上不断循环和递进的菌种改进与生物过程整体优化的必要性和艰巨性。唯有不断循环和递进改造菌种和优化过程,才能最终充分发挥酿酒酵母平台cAMP生产潜力,开辟微生物发酵生产cAMP新途径,真正推动高值医药产品的绿色清洁生产。
Preliminary optimization of process to improve cAMPproduction bySaccharomycescerevisiae
QIU Shen-shen1,2, DING Juan-juan1,2, QU Shu-ling3, ZHANG Yi-qun3,LU Hai-yan1,2, ZOU Shao-lan1,2*
1(School of Chemical Engineering and Technology,Tianjin University,Tianjin 300350,China) 2(Key Laboratory of Systems Bioengineering,Ministry of Education,Tianjin 300350,China) 3(Petro China Dagang Oilfield In Tuanbowa Development Company, Tianjin 301607, China)
ABSTRACT 3’,5’-cyclic adenosine monophosphate (cAMP) is a key second messenger.It′s synthesis is strictly controlled.In this study, a genetically-modified yeast strain G2 in our lab was used for preliminary fermentation process optimization to improve extracellular cAMP production and investigate the key parameters.It showed that the most important parameters were the contents of glucose, yeast powder and peptone, and their ratio.The fermentation medium containing 100 g/L glucose and 2*YP (20 g/L yeast powder, 40 g/L peptone) led to the maximum cAMP concentration of (4 311.2±308.3) μmol/L, while the medium containing 100 g/L glucose and 1*YP produced cAMP (1 972.0±122.5) μmol/L.Adding precursor adenine to the forementioned media would further increase the cAMP concentration to (4 678.1±238.6) and (3 387.3±277.8) μmol/L, respectively.On the other hand, addition of precursor hypoxanthine led to the cAMP titer increase by 6.65% in the medium containing 100 g/L glucose and 1*YP.All of those results provided the clue for further optimization of fermentation process and modification of the cAMP-producing strains.
Key words Saccharomycescerevisiae;3’,5’-cyclic adenosine monophosphate (cAMP); fermentation; process optimization; adenine
DOI:10.13995/j.cnki.11-1802/ts.013491
引用格式:仇申珅,丁娟娟,曲淑玲,等.发酵工艺初步优化提高酿酒酵母工程菌株环磷酸腺苷产量[J].食品与发酵工业,2018,44(5):104-108;114.
QIU Shen-kun, DING Juan-juan, QU Shu-ling,et al.Preliminary optimization of process to improve cAMP production bySaccharomycescerevisiae[J].Food and Fermentation Industries,2018,44(5):104-108;114.
第一作者:硕士研究生(邹少兰副研究员为通讯作者,E-mail:slzhou@tju.edu.cn)。
基金项目:国家高技术研究发展计划(863计划,2012AA02 A701)
收稿日期:2016-11-25,改回日期:2018-01-11