关键词: 合成生物学 化学品 细胞工厂 多酶分子机器
Current Situations and Perspectives of Industrial Applications of Synthetic Biology
ZENG Yan, ZHAO Xingang, ZHOU Ju
Bureau of Science & Technology for Development, Chinese Academy of Sciences, Beijing 100864, China Author: ZENG Yan Associate Professor of Bureau of Science and Technology for Development, Chinese Academy of Sciences (CAS), Ph.D.of biocatalysis.She is mainly responsible for biotechnology projects management, techtransfer, etc. E-mail:zengyan@cashq.ac.cn
ZHOU Ju Director of Division of Biotechnology, Bureau of Science and Technology for Development, Chinese Academy of Sciences (CAS), Ph.D.of biochemistry.He is mainly responsible for biotechnology projects management, tech-transfer, etc. E-mail:zhouju@cashq.ac.cn
Corresponding author: ZHOU Ju
Abstract: Biosynthesis of chemicals through synthetic biology can partially relieve the dependence on petroleum resources. With the development of synthetic biology technology, the capabilities of constructing microbial cell factories for production of chemicals have been greatly improved. Development of new engineered strains and new bioprocess can replace the traditional manufacturing process, decrease the energy cost and pollution, and improve the producing capabilities of traditional fermentation industry. In this review, key factors and representative cases for constructing microbial cell factories and multi-enzyme molecular machines to produce chemicals were summarized. The future of industrial applications of synthetic biology were also discussed.
Keywords: synthetic biology chemicals cell factories multi-enzyme molecular machines
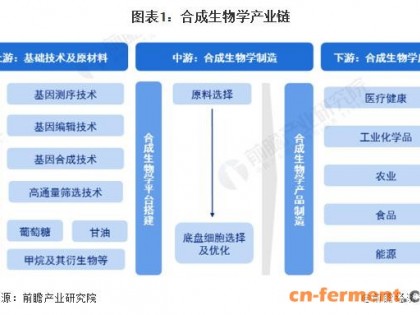
化工炼制是工业社会必需物质资源的传统获取途径。但化工炼制以不可再生的石油资源为基础,很多生产过程存在高能耗、高污染的问题[1]。以绿色清洁的方式实现化学品的生产,对于实现国民经济的可持续发展至关重要。通过合成生物学技术,可以改造自然界中微生物的合成能力,甚至创造新的合成途径。通过构建高效的细胞工厂,利用可再生的生物质资源为原料生产各种化学品,发展生物制造产业,将有力促进国家经济发展方式的转变,确保节能减排的目标实现。
本文对利用合成生物学技术构建细胞工厂,以及构建多酶分子机器来生产化学品的关键因素和典型案例进行了综述,并对合成生物学技术工业应用的未来进行了展望。
1 合成生物学技术构建微生物细胞工厂的技术路线
转化率、生产速率和产量是决定微生物细胞工厂是否能实现工业应用的3个关键指标。通过最优合成途径的设计、合成途径的优化和细胞生理性能优化,可以显著提升微生物细胞工厂生产化学品的转化率、生产速率,最终实现产量增加。
1.1 提高转化率:最优合成途径的设计路径
化学品生物制造的成本中,原料成本所占比重最大(通常超过50%),因此提升微生物细胞工厂的转化率是实现工业化应用最为关键的因素。转化率越高,生产化学品所需要消耗的原料越少,成本也就越低。在设计最优合成途径时,底物的碳代谢流和还原力的供给是两个关键因素。自然界中微生物的代谢网络非常复杂,为了获得最大的转化率,要改变底物的碳代谢流,使其最大限度地集中于目标化学品的合成。因此,细胞工厂的构建首先需要创建微生物的基因组代谢网络和调控网络模型,然后在此基础上设计出目标化学品的最优合成途径,避免其他副产物的竞争,使目标化学品的合成途径在热力学上可行,合成过程能量供给充足[2]。除了碳代谢流分布之外,还原力的供给也至关重要。底物代谢产生的还原力要满足化学品合成所需的还原力。
1.2 提高生产速率:合成途径的优化手段
微生物细胞工厂生产化学品的生产速率,是决定生物制造成本的另一个关键因素。生产速率高,发酵周期就短,成本也就越低。要达到较高的生产速率,需要保证合成途径能高效运转。化学品的生物合成途径通常都是由一系列酶催化反应组成。自然状态下微生物的合成途径中,各个酶的催化效率达不到非常协调的状态。有些酶的催化速率慢,成为合成途径的限速步骤;有些酶的催化速率快,导致中间代谢物积累,对细胞生长和代谢产生毒性作用。这些都会导致合成途径的整体效率低,制约了细胞工厂的生产速率。因此,需要对合成途径进行优化,使其达到平衡协调的状态,目前主要有3种手段。
(1)多基因调控技术。多基因调控技术通过对染色体上的多个基因同时进行改造,结合高通量筛选技术,可以快速高效地鉴定出最优的调控组合[3]。标准化的调控元件文库,如启动子、核糖体结合位点和信使RNA稳定区文库,为基因改造提供了坚实的元件基础。基于质粒表达的小分子RNA技术能大规模调控目标基因的表达,实现合成途径的精确调控[4]。
(2)基因动态调控技术。根据基因转录因子与代谢关键中间物的相互作用,可以开发出动态感应调控系统(dynamic sensor-regulator system)来调控基因的表达。与传统调控系统相比,动态调控系统具有智能性,可以根据选定的某种细胞体内代谢信号自动调节特定基因的表达,从而维持代谢途径的动态平衡,达到提高产品合成能力的目标[5]。
(3)蛋白骨架技术。在细胞体内的代谢途径中,参与反应的酶的空间位置是影响代谢途径效率的一个重要因素。通过人工合成的蛋白骨架,使酶以特定位置和序列附着在骨架上,可以控制代谢途径中酶的空间位置,从而使合成途径相邻的酶聚集在物理空间比较近的区域,使底物和酶距离接近,提高生化反应的速率[6]。另外,蛋白骨架也可以调节酶催化效率,通过这项技术可以获得最优组合,最终提高细胞工厂的性能[7]。
1.3 增加产量:细胞生理性能优化方法
合成途径优化之后,可以获得一个初步的细胞工厂。但要让其实现工业应用,还需进一步优化细胞的生理性能。为了获得高产量,需要让细胞能适应高渗透压。为了能在酸性条件下发酵生产有机酸,避免添加中和剂、简化下游分离提取工艺,需要让细胞能适应酸性环境。同时,为了避免污染和节约能耗,需要让细胞适应高温。进化代谢和全局扰动等技术的发展可以有效地提高细胞的生理性能[8-11]。在此基础上,使用各种高通量组学分析技术可以解析细胞性能提升的遗传机制,并可用于新一轮细胞工厂的构建。
2 微生物细胞工厂工业应用的代表性案例
使用上述技术路线,国内外研究人员创建出一系列微生物细胞工厂,实现了很多以前只能通过化工炼制生产的化学品的生物制造,提升了很多传统发酵产品的技术水平,在节能降耗方面效果显著。
2.1 新型化学品的生物制造
(1)1, 3-丙二醇。 1, 3-丙二醇是一种重要的化工原料,广泛应用于聚酯、聚醚、聚氨酯,以及涂料、去污剂、黏合剂等的合成。1, 3-丙二醇与对苯二甲酸缩聚而成的对苯二甲酸丙二醇酯(PTT)不仅可生物降解,还具有尼龙的柔软性和弹性、腈纶的蓬松性、涤纶的抗污性等特点,是一种性能非常优异的新型材料。20世纪初期,随着石油价格的愈发波动和不断上涨,一些国际石油化工巨头开始探索生物制造技术,以此来部分替代石化制造路线,丰富技术和产业链条。其中最具代表性的是美国杜邦公司,其代表性生物技术产品便是1, 3-丙二醇。自然界中一些微生物能将甘油高效转化为1, 3-丙二醇。然而甘油原料的成本相对较高,而且由于受到还原力调控,甘油作为唯一碳源生产1, 3-丙二醇的理论最大转化率只有0.75 mol/mol,导致这条生产路线的成本较高。杜邦公司首次设计并创建了以葡萄糖为原料生产1, 3-丙二醇的生物合成途径。将来自酿酒酵母的甘油合成途径和来自肺炎克雷伯菌的1, 3-丙二醇合成途径导入大肠杆菌,敲除磷酸葡萄糖转移酶系统(PTS系统)并下调甘油醛-3-磷酸脱氢酶减少进入三羧酸循环(TCA循环)的碳代谢流,促进葡萄糖向甘油的代谢,显著提高了葡萄糖到1, 3-丙二醇的转化率。最终构建出的细胞工厂1, 3-丙二醇产量达135 g/L,生产速率达3.5g/(L·h),葡萄糖转化率为0.83 mol/mol[12]。基于这一技术,杜邦公司建立了年产4.5万吨1, 3-丙二醇的产业化生产线,并开发了一系列PTT衍生材料产品。与传统石化制造路线相比,生物法1, 3-丙二醇技术的能耗降低40%,CO2排放减少40%。清华大学、北京化工大学、华东理工大学也开展了以甘油为原料生产1, 3-丙二醇的研究工作。随着生物法1, 3-丙二醇技术的大获成功,杜邦公司调整其战略投入,不断加大在生物技术领域的研发投入和对生物制造产业的推动。目前,杜邦公司20%产值来自生物产业。
(2)萜类化合物。萜类化合物是植物天然产物中最大的种类,是液体燃料、橡胶、香精香料等的主要成分。萜类化合物不仅是重要的工业原料,在医药领域也有广泛用途。美国加州大学伯克利分校Jay Keasling教授与美国Amyris公司构建了合成生物学发展历史上的第一个代表性产品——青蒿素,在萜类化合物的细胞工厂开发方面作出了重要贡献。Amyris公司通过构建酿酒酵母细胞工厂生产疟疾治疗药物青蒿素的关键前体——青蒿酸,再将青蒿酸转化为青蒿素[13]。2013年5月,世界卫生组织批准细胞工厂合成的青蒿素作为临床药物使用,从而使青蒿素的生产摆脱了传统植物提取方式的局限,不再受土地、气候、时间等植物生长的制约,可以通过发酵罐实现青蒿素的工业化生产,为在世界范围内消除疟疾提供了可能。
(3)L-丙氨酸。 L-丙氨酸是一种重要的平台化学品,用于生产表面活性剂、维生素B6和氨基酸注射液,全球市场需求在5万吨/年。目前L-丙氨酸的生产技术都是以石油基顺酐为原料,制得天冬氨酸后再脱羧生成L-丙氨酸。该技术使用的原料不可再生,生产过程中会排放大量的CO2。天然微生物虽然有将葡萄糖转化为L-丙氨酸的生物合成途径,但L-丙氨酸的产量和转化率都非常低,和酶法路线相比没有竞争力。中国科学院天津工业生物技术研究所通过L-丙氨酸最优途径设计、合成途径重建、合成途径精确调控和细胞性能优化,构建出将葡萄糖高效转化为L-丙氨酸的细胞工厂[14]。目前,该技术指标达国际最高水平,并且利用该技术建成年产3万吨L-丙氨酸的生产线,在国际上首次实现发酵法L-丙氨酸的产业化,生产成本比传统技术降低52%。随着发酵法L-丙氨酸的量产,以德国巴斯夫公司为首的世界化工巨头开始以其为原材料制造新型环保的无磷洗涤剂甲基甘氨酸二乙酸(MGDA)替代传统的含磷洗涤剂,这一工作对保护水体生态环境意义重大。
2.2 传统产品的产业提升
(1)乙醇。纤维素乙醇产业化的主要瓶颈之一是缺乏能同时代谢木糖和葡萄糖的酵母。中国科学院分子植物科学卓越创新中心下属上海工业生物技术研发中心,在诺维信公司和山东大学的协助下,在酿酒酵母中导入木糖异构酶基因并经驯化适配,实现了玉米秸秆和气爆处理甘蔗渣的高速发酵能力[15]。该木糖利用酵母已在美国等多个国家申请专利,并与国内外多个纤维素乙醇项目签署酵母供货协议。2017年利用该酵母生产2 800万升纤维素酒精,估计占全球二代乙醇份额的一半以上。这一成果标志着我国的酒精发酵酵母设计与构建技术进入国际先进行列。
(2)正丁醇。正丁醇是具有多种用途的大宗基础化工原料,也是一种性能高于乙醇的优质燃料。以产溶剂梭菌为生产菌的生物法合成正丁醇曾经是仅次于乙醇的世界第二大生物制造技术产业。中国科学院分子植物科学卓越创新中心最早在国内系统性地开展了梭菌正丁醇发酵研究。通过建立基因编辑的新工具,发现新的调控元件和机制,构建高效普适的底盘,以及重构新产物途径等手段,构建了新一代能利用多种非粮原料的工程菌株,拓展了梭菌发酵的底物谱(糖基碳源、木质纤维素和气体碳源),实现了更高的正丁醇合成能力,表现出优良的耐毒和五、六碳糖共发酵能力[16]。该团队近期实现了利用一碳气体合成正丁醇的目标,并已与企业开展技术合作,推进新技术的研发和应用。
(3)赖氨酸。赖氨酸广泛用于动物饲料、医药健康、化工新材料等。我国是赖氨酸生产大国,2017年产量达157万吨,占全球份额的56.5%。作为传统大宗发酵产品,其生产菌种经过近半个世纪的改造,发酵水平已经很高,继续提升难度非常大。但是,由于我国赖氨酸产业迫切需要升级换代,以提高经济效益,促进节能减排,增加国际竞争力,因此研发新一代赖氨酸发酵菌种已经迫在眉睫。通过建立计算机菌种设计、关键酶理性设计、代谢途径重构、菌种智能进化筛选等一整套核心菌种研发体系,中国科学院天津工业生物技术研究所成功开发新一代赖氨酸合成菌种,转化率居世界领先地位,核心专利在中国、日本、美国等国已获得授权[17]。
3 多酶分子机器
化学品的生物制造一共有两条技术路线。除了微生物细胞工厂这条主要的技术路线外,多酶分子机器这条技术路线近几年来也得到广泛关注。由于很多化学品对微生物细胞的毒性较大,因此微生物细胞工厂在生产这类化学品时很难获得高产量。多酶分子机器不需要使用微生物细胞,在生产有毒化学品时具有较大优势。该技术通过在反应釜中添加1种或多种酶,将生物质原料高效转化为化学品。多酶反应的设计、酶的挖掘与高效制备是该技术路线最核心的环节。多酶分子机器生产化学品最具代表性的案例是氢气和肌醇的生物制造。
(1)氢气。氢气是未来最有前景的清洁能源,并普遍作为燃料电池的动力源。目前氢气制备主要使用水煤气法和电解水法,这些工艺对设备要求高,导致制氢的成本较高,并且氢气不易储存和运输。美国弗吉尼亚理工大学的科研人员利用多酶分子机器技术,将14种酶和1种辅酶进行适配,利用生物质原料,能够从1个葡萄糖单元获得12个氢气分子[18]。该技术解决了氢气的储存和运输问题,为未来氢能汽车提供了能源供应方案。
(2)肌醇。肌醇是水溶性B维生素的一种,是动物与微生物生长的必需物质,广泛应用于饲料、医药、食品等行业。目前国内主要采用传统的高温加压水解植酸法生成肌醇。该工艺设备材质要求严格,一次性投资大,原材料利用率低,粗产品精制工艺复杂,生产成本高;并且该工艺会产生大量的磷酸污染物,对水源、环境污染严重。通过采用多酶分子机器技术,中国科学院天津工业生物技术研究所研究人员利用α-葡聚糖磷酸化酶、葡萄糖磷酸变位酶、肌醇-3 -磷酸合成酶和肌醇单磷酸酶创建了一条由淀粉到肌醇的体外生物合成路线[19]。该绿色催化工艺能替代传统高污染、高能耗生产工艺,不仅使肌醇的生产成本降低为传统植酸水解法的一半,而且大幅减少了环境污染。
4 合成生物学工业应用未来展望
近年来世界范围内合成生物学技术迅猛发展,我国在此领域人才储备不断扩大,技术能力不断提升,在整体发展水平上保持了与国际同行。在合成生物学技术的推动下,我国生物制造产业快速进步。氨基酸、维生素等传统产品的技术升级不断推进,在一些重要产品上已经能部分绕开专利封锁。在新产品开发上,国外有长链醇、1, 4-丁二醇、对苯二甲酸等一系列重要大宗化学品的生物制造技术,而我国科学家在肌醇、3-羟基丙酸、己二酸等化合物的生物制造技术上实现世界领先。在新酶设计、新合成途径设计这些最前沿、决定未来产业布局的研究方向上,保持了与国际并行。
但同时必须认识到,面向国际市场竞争,在我国生物制造产业中,玉米等重要发酵原料的高昂成本始终是一大劣势。因此,要实现生物制造产业的突破,打造我国生物制造产业的国际竞争力,在现有合成生物学工业应用的基础上还需大力发展非粮原料的利用技术。一方面,要开发木质纤维素利用技术,使微生物细胞工厂能高效利用秸秆、木屑等非粮生物质;另一方面,可以探索以CO2等为主要原料的生物技术,探索全新的碳利用途径。随着国家和人民对生态环境保护的日益重视,未来我国的生物制造产业对废水废物的排放将有更高的要求,这就要求我们不断去提升细胞工厂技术,在降低分离提取技术成本的同时,最大限度地减少副产品的合成,从而减少对环境的污染。
合成生物学现有的发展多是基于自然界中已有生物合成途径的化学品实现生物制造。然而,绝大部分化学品是没有天然生物合成途径的,这为今后生物制造产业的发展带来很大的挑战,但也正是合成生物学真正展现其颠覆性价值之处。目前能从头创建化学品全新生物合成途径的报道还非常少,最大的瓶颈之一是新酶设计能力。要实现人工构建全新的合成途径,必须将计算生物学、合成化学、化学生物学、蛋白质科学等多学科进行深度的交叉融合,才能在新酶设计方面获得突破。因此,多学科会聚以及更广泛合作网络的构建,将是未来合成生物学发展的重要特点。
致谢 感谢中国科学院天津工业生物技术研究所张学礼、毕昌昊、孙际宾、郑平、游淳、田朝光、张大伟、朱欣娜、于勇和中国科学院上海植物生理生态研究所杨晟、姜卫红为本文撰写提供的帮助。
参考文献[1] 张学礼.合成生物学促进微生物细胞工厂构建.中国科学报, 2013-01-02(6).
[2] McShan D C, Rao S, Shah I. PathMiner:predicting metabolic pathways by heuristic search[J]. Bioinformatics, 2003, 19(13): 1692-1698. DOI:10.1093/bioinformatics/btg217
[3] Wang H H, Isaacs F J, Carr P A, et al. Programming cells by multiplex genome engineering and accelerated evolution[J]. Nature, 2009, 460(7257): 894-898. DOI:10.1038/nature08187
[4] Na D, Yoo S M, Chung H, et al. metabolic engineering of Escherichia coli using synthetic small regulatory RNAs[J]. Nature Biotechnology, 2013, 31(2): 170-174. DOI:10.1038/nbt.2461
[5] Zhang F, Carothers J M, Keasling J D. Design of a dynamic sensor-regulator system for production of chemicals and fuels derived from fatty acids[J]. Nature Biotechnology, 2012, 30(4): 354. DOI:10.1038/nbt.2149
[6] Lee M J, Mantell J, Hodgson L, et al. Engineered synthetic scaffolds for organizing proteins within the bacterial cytoplasm[J]. Nature Chemical Biology, 2018, 14(2): 142-147.
[7] Dueber J E, Wu G C, Malmirchegini G R, et al. Synthetic protein scaffolds provide modular control over metabolic flux[J]. Nature Biotechnology, 2009, 27(8): 753-759. DOI:10.1038/nbt.1557
[8] Badarinarayana V, Estep P W Ⅲ, Shendure J, et al. Selection analyses of insertional mutants using subgenic-resolution arrays[J]. Nature Biotechnology, 2001, 19(11): 1060-1065. DOI:10.1038/nbt1101-1060
[9] Alper H, Moxley J, Nevoigt E, et al. Engineering yeast transcription machinery for improved ethanol tolerance and production[J]. Science, 2006, 314(5805): 1565-1568. DOI:10.1126/science.1131969
[10] Jarboe L R, Zhang X, Wang X, et al. metabolic engineering for production of biorenewable fuels and chemicals:contributions of synthetic biology[J]. Journal of Biomedicine and Biotechnology, 2010, 761042. DOI:10.1155/2010/761042
[11] Lynch M D, Warnecke T, Gill R T. SCALEs:Multiscale analysis of library enrichment[J]. Nature Methods, 2007, 4(1): 87-93. DOI:10.1038/nmeth946
[12] Charles E N, Gregory M W. metabolic engineering for the microbial production of 1, 3-propanediol[J]. Current Opinion in Biotechnology, 2003, 14(5): 454-459. DOI:10.1016/j.copbio.2003.08.005
[13] Ro D K, Paradise E M, Ouellet M, et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast[J]. Nature, 2006, 440(7086): 940-943. DOI:10.1038/nature04640
[14] 张学礼, 张冬竹.一种高产L-丙氨酸的XZ-A26菌株及构建方法与应用: 中国, ZL201110235159.8, 2014-11-23.
[15] Diao L, Liu Y, Qian F, et al. Construction of fast xylosefermenting yeast based on industrial ethanol-producing diploid Saccharomyces cerevisiae by rational design and adaptive evolution[J]. BMC Biotechnology, 2013, 13(1): 110. DOI:10.1186/1472-6750-13-110
[16] Jiang Y, Liu J, Jiang W, et al. Current status and prospects of industrial bio-production of n-butanol in China[J]. Biotechnology Advances, 2015, 33(7): 1493-1501. DOI:10.1016/j.biotechadv.2014.10.007
[17] Yue G, Sun J, Zheng P, et al. Asparaginic acid kinase Ⅲ mutant and host cells and use thereof: USA, US9896734 B2, 2013-05-16.
[18] Zhang Y P, Evans B R, Mielenz J R, et al. High-yield hydrogen production from starch and water by a synthetic enzymatic pathway[J]. PLoS One, 2007, 2(5): e456. DOI:10.1371/journal.pone.0000456
[19] You C, Shi T, Li Y, et al. An in vitro synthetic biology platform for the industrial biomanufacturing of myo-inositol from starch[J]. Biotechnology and Bioengineering, 2017, 114(8): 1855-1864. DOI:10.1002/bit.26314