摘要:
放线菌(Actinomycetes)是许多临床重要抗生素的来源,大多数太复杂了而不能被化学合成. 放线菌额外生产的抗生素可透过对新式的添加培养和全细胞筛选方法从土壤和海洋沈淀物中发现.合并的生化合成法能产生很难用药用化学制造的复杂抗生素衍生物和其他二次代谢物. 定序放线菌基因体可提供设计新颖的抗生素有用的洞察力。
罗马两面神Janus能同时往前和往后看.Janus效应为与公司行政长官的效率有关,加利福尼亚商业大师 James Kouzes 与 Barry Posner 认为回顾最长的行政长官也是最提前作有效计画的那些人。
就抗生素的发现而言,我们考虑过去以提升我们的远见.近来,发展前景贫瘠,尤其在几家大的医药公司最近放弃他们的天然产品和传染病研究计划之后。而且,尽管拥有强有力的实验工具(例如基因体学,合成的化学和高产率胞外筛选),我们仍不能鉴定新抗生素。
考虑过去
大多数临床使用抗生素是来自放线菌或者真菌直接的天然产品或者半合成品的衍生物.大多数那些产品,包括erythromycin 和其衍生物,vancomycin 和teicoplanin,cephalosporins,rifamicin,tetracyclines 和daptomycin,是由全细胞抗生素筛选程式发现.同时,近年来建立的目标基处研究使用细菌遗传学,合成化学的发现的来临,高产率胞外筛选,还没有产生任何符合临床使用的抗生素且成功前景不乐观.。
针对病原体从放线菌和真菌萃取物筛选鉴定抗生素的传统方法不再被认为为很炫的科学.然而,病原体的全细胞筛选可能让人震撼。
对比起来,高产率胞外筛选取决於找到一个针对特定或假设目标有的活性.通常,它搜寻化学物的资料库中能抑制病原体的一种酵素的. 如果化学物有如此活性,药用化学家修饰他,确保渗透,稳定,毒性,在组织扩散,从身体适当的代谢.这样的工作经常失败。
在另一方面, 放线菌或者全细胞培养液筛选迅速生物学诱发出生物活性,因为那些培养液只针对真正具有药物性质或潜力的目标筛选,包括同时对多种物质筛选.全细胞筛选也为候选分子是否进入细胞的外部障碍以及对病原体的活性测试。
当我们考虑在胞外筛选的关键差别时,这"低科技"看来非常合乎逻辑. 但是很多医药公司停止倚赖这逻辑.相反地,开始使用基因体学,合成的化学和高产量,针对目标的对全部治疗的地区进行筛选,包括的搜寻新式抗菌产品.他们如此做却没有先合理化这种方法。
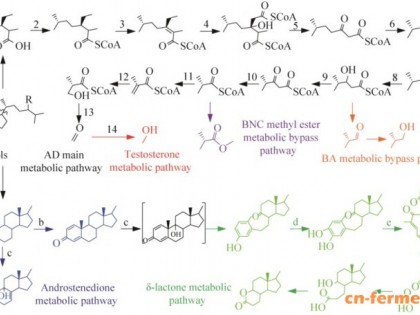
Actinomycetes抗生素的代谢途径复杂多样
erythromycin 和streptomycin 生化合成路径是至少5亿年历史,而vancomycin biosynthetic小路生化合成路径,包括vancomycin抗性的机制 VanA,是至少2亿年.其他抗菌的生化合成路径似乎不这麼老,并且被用土壤样品较不广泛分布.通常,新生化合成路径很可能不是到处散步并且难以发现.不过,生产抗生素的actinomycetes在土地是大量的.根据一些估计,全球土壤10名公分深包含1025-1026种 actinomycetes,但是只有107种在过去的50年中成为抗生素产品,为更进一步筛选留下许多的空间。
考虑土壤中放线菌生化合成路径的分布.
几十年以前, 在钮泽西 New Brunswick 的Rutgers大学的研究人员,与Boyd Woodruff 和他在钮泽西 Rahway 的默克公司合作伙伴,在随机收集土壤中的放线菌,发现 10% 有streptothricin,主要种类是Streptomyces. Streptothricin约占土壤放线菌1%,tetracycline 和 actinomycin 约0.1%.难怪这些是最早发现的抗生素。
erythromycin 和 vancomycin 生化合成路径少的多了.大约分别的机率为5 x 10-6 和1.5 x 10-5.虽然如此,他们在20世纪50年代被低产率的方法大量分离.很多其他抗生素,或许有2000种在1–2 x 10-7的机率被分离,包括最近被供临床使用核准的 daptomycin。
我估计在每一个放线菌筛选到其他抗生素机率是107或更低.一项挑战是,其他更普遍和已知抗生素也在这些搜寻中常出现, 并且他们需要被除去. 换句话说, 在全部已知的抗生素中,最普遍的生菌素的频率分布远超过最稀有抗菌素(图1)的. 除不重新发现已知的抗生素以外,超过107放线菌需要被筛选以发现一个以上的抗生素.这些搜寻工作要求高产率的筛选或者特殊取样方法和选择性培养未曾研究的放线菌。
Macrodroplets 简约化新的抗生素筛选
在 Cubist 医药制品,我们每年筛选超过107 的放线菌,使用简单的步骤分离及培养.例如, 取代孢子萌发地, 孢子被包装成 Ca2+-alginate macrodroplet小珠,那是直径2毫米并且包含营养的并添加 naladixic acid, trimethoprim, nystatin的培养基,并以cycloheximide抑制任何非 actinomycete 的细菌和真菌. 放线菌孢子萌发,菌丝生长,分化,并且在小珠里产生第二代谢物.我们使用这种方法用最小的自动化每年筛选数百万个 actinomycete 孢子.
当每年筛选数百万个孢子时,除去已知抗生素是关键的.在 Cubist,我们筛选针对 Escherichia coli,寻找对这个革兰氏阴性病原体有活性的任何化合物.因为超过 60% 的已知抗生素只对革兰氏阳性的细菌有活性, 我们针对E. coli简化筛选,使我们能够集中於考虑关键与大部分的临床挑战。E. coli 让我们透过使用遗传学排除最常见的广效抗生素.例如,特定对streptoth ricin,streptomycin,
tetracycline,chloramphenicol,bleomycin,ampicillin,
rifampin,multiple aminoglycosides 有抗性的基因被插入E. coli K-12 染色体中,同时地删除对 albomycin 的抗性.另外,透过插入 naladixic acid 和 trimethoprim 抗性, 我们使E. coli 在添加抑制非 actinomycete 细菌的抗生素培养下生长. 把多种抵抗基因插入E. coli 染色体中使我们的试验株在降低总命中率到少於0.1%时更容易保持,因为我们能排除那麼多已知的抗生素.这种方法依次使随后有希望为候选抗生素的架构分析更容易管理。
使用 Metagenomic 寻找新式抗生素的问题
Metagenomic 方法对难以培养微生物的鉴定很有用并且也能用来区分他们的基因. 虽然研究人员在Aventis,TerraGen,Diversa,和在一些学术实验室使用metagenomic 方法寻找新式抗生素,但是他们没有实际的成功. metagenomics为什麼失败问题在大部分在於技术限制和可产生新式抗生素的微生物很多都无法培养. 简单的审视无法培养的微生物给大类型所转译的 large type I polyketide synthase(PKS) 和 nonribosomal peptide synthetases(NRPS) 可帮助满足现今的缺失.这些酵素的基因,是复杂的抗菌的生化合成基因组的标记,没在从高机率土壤样品随机复殖的DNA中被发现.
同时,考量 metagenomic 方法可区分出新式抗生素的合成路径.一克新鲜土壤包含大约109个菌落,其中大约有107是放线菌大量生产抗菌素和其他重要二次代谢物的生产者.如果109可培养细菌以 metagenomic 为基础的比率估计出在土壤里占微生物的1%,每克土壤就有1011不可培养微生物的基因体. 从土壤样品能以 cosmid 和 BAC 资料库区分已知的生化合成路径基因作为原则. 例如,土壤中的放线菌最常制造 streptothricin.基於 Boyd Woodruff's 几十年前描述,我们估计生产 streptothrici 的放线菌在每克土壤大约有106CFU. Streptothricin biosynthetic生化合成基因组小到足以在一cosmid 载体上复殖. Streptomycete 基因是大约 8 Mb,一个含大约400个复殖的资料库应该包含一个分离株群. 因为在1克土样中约有1011 无法培养的微生物,streptothricin 制造者大约在105的微生物基因组中出现1个.为了分离这一个streptothricin基因组,我们首先需要准备一个 400 x 105 (或者4 x 107 ) 的cosmid资料库,然后转移资料库到可表现所有调控基因组的 streptomycete 宿主细胞,然后为streptthricin 筛选复殖细胞.这个计画的问题明显地来自不利的数字.首先,从土壤中萃取DNA 做出4 x 107的cosmid资料库在技术上是不可行的. 为目前极限的1,000倍. 其次,cosmids从E. coli转移到streptomycetes大约只有10-4到10-5的效率,更进一步降低成功的可能.因此,难怪还没有人复殖 streptothricin biosynthetic基因群,表示 metagenomic 还在能力所及的范围之外.
第2种 metagenomics 局面是分离出出一个新式抗生素合成路径.根据估计,生产新抗生素的很可能在107 放线菌出现1个或更少.而且,任何抗生素的转译基因组不大可能在单一个的 cosmid上被攫取,从 daptomycin例子判断.一个细菌的人造染色体(BAC) 像这样的复杂的路径需要的复殖通常为100 kb的DNA.与生产 streptothricin 的放线菌不同,每克土壤中1011放线菌中的任何未被发现的生产抗生素的基因可能只有1个,并且需要大约2 x 1013个复殖的一个 BAC资料库找到那条生化合成路径.虽然有12到85 kb由土壤中DNA准备而成的插入序列来自大约尺寸的 2x 104 复殖的BAC资料库, 这项技术仍然太没效率不能成为抗生素的生化合成基因组的工作.
Metagenomics在唯一目前想像中可行的是,如果一些非常普遍的无法培养的微生物-数量比普通的可培养微生物更多的它们,当他们的基因被复殖到E. coli时可以产生抗生素.因为一个104个复殖的BAC资料库代表约 100 基因体编码讯息的量,然而这种方法的可能性成功是微乎其微的.
因此,集中於发展方法来培养不可培养的微生物来的较有意义,然后每年筛选数百万而不是只有数百种.例如,在麻州剑桥的 NovoBiotic 医药制品的研究人员,正研究分离和学习怎样培养不能於标准实验培养基培养的稀有放线菌。 更进一步定序基因的代价使放线菌基因寻宝可行Streptomyces avermitilis 和 Streptomyces coelicolor的基因体序列正提供对潜在於个别的 streptomycetes 的二次代谢路径的洞察力.两者皆包含数十种潜在的 PKS 和 NRPS代谢路径. 同时,在圣者劳伦特,魁北克,加拿大 Ecopia BioSciences公司的研究人员,使用微生物基因体学从放线菌预测以前未辨视出的二次代谢物架构.他们为产生那些化合物优化发酵条件.因为基因排序方法变得不那麼昂贵,可能值得去排序许多不同放线菌基因,包括来自陆地和海上的稀有种和新种.来自这样的努力的数据可能诱发出新的,包括抗菌活性的二次代谢物. 数据也将引导研究者以新基因作生化合成.
海上Actinomycetes是新式抗微生素的来源
超过70%的地球的表面被由水盖住. 放线菌约占海上细菌10%,并且可从海洋沈淀物分离,包括那些从离玛丽安娜海沟的最深的部分10898米的深度所获得的. 很多从这麼深海洋中分离的actinomycetes包含NRPS 和PKS代谢路径,也是二次代谢物生产的标记.尽管他们数量很丰富,然而海上沈淀物和海上无脊椎动物是新的二次代谢物的未开发的来源.
有趣的例子是,最近分离的新式的二次代谢物包括 abyssomicin C,salinosporamide A. Abyssomicin C是由日本海在289米的深度分离的Verrucosispora产生,因此它的名字是来自"abyss"的抗生素.这个 polycyclic polyketide 抗菌活性在於抑制在叶酸代谢路径内 para-aminobenzoic acid 的合成.它和它的类似物正被评估为抵抗格兰氏阳性病原体的治疗候选药. Salinosporamide A是一种 -lactone - lactam proteosome 抑制剂由海生的actinomycete Salinispora tropica产生.这化合物正被加利福尼亚圣地牙哥的Nereus医药制品公司临床试验治疗肿瘤和淋巴腺癌.
生化合成也能产生新式抗生素
研究人员在过去25年中一直为遗传工程生化合成路径发展新方法. 与这些研究平行的发展的是基础生物化学的研究:巨大的multisubunit,multienzyme NRPSs 和PKSs复杂二次代谢物的机制.同时,这些机制和精简的遗传工程研究使得难以用药物化学合成的抗生素和其他二次代谢物的衍生物的生化合成可实行.抗生素生化合成路径经几十亿年逐步演化形成,而研究计画进度表是从1到10年.因此,生化合成工程要以107到109倍的速度进行. 这种方法或许不能产生新式抗生素.
不过,生化合成现在很适合使改进已知而无法透过传统药用化学方法改进的抗生素. 例如,生化合成用来透过修改 polyketide 架构然后加入糖和甲基使他们产生还原态macrolide erythromycin的衍生物.tylosin 和spinosad的生化合成路径也被成功设计,新式 spinosyns 用以改进杀虫剂的广效性. 同时, 与 vancomycin 有关的几个 glycopeptide 抗生素和 teicoplanin 在胞外胞内透过合成化学酵素,发酵作用,以及遗传工程方法被修改.类似地,像daptomycin一样的 lipopeptides 被合成化学酵素方法,生化合成法产生.
这样被使用的方法的其他成功例子包括透过结合 staurosporin 和 rebeccamycin 生化合成路径的组成部分混合的展, 以及透过混合novobiocin 和 chlorobiocin 路径产生的gyrase-topoisomerase IV 发展抗癌的抗生素. 通常,在学术实验室工作的研究人员和生物科技公司把这些发展视为生化合成.不过,这拼凑品并不理想,并且更多一致性的努力能帮助意识到这项技术的潜力.的确,发现真正的新抗生素要求一更大视野,长期,国际合作研究.这些努力也应该包括多种放线菌基因的排序促进我们的知识范围和存在於放线菌二次代谢路径的种类,并且要在生化合成里利用这些基因知识.这样的一次努力无疑地将引导针对癌症和免疫抑制第二次代谢物的发现和新用途, 来自放线菌的天然产品已经做了实际贡献.