(1 科技部果蔬加工与质量安全创新团队 长沙410125 2 湖南省农业科学院 长沙410125 3 湖南大学研究生院隆平分院 长沙410125)
摘要 因柑橘中类黄酮化合物含量丰富,具有多种生理活性功能而被广泛应用于食品、药品、化妆品等行业。类黄酮主要从柑橘等植物中提取,少量通过化学合成或结构修饰。近年来,在大肠杆菌、酿酒酵母等宿主菌中构建代谢通路异源合成类黄酮的微生物方法已进入研究阶段,其具有安全性高,绿色环保,可持续发展的特点。本文简述了柑橘中类黄酮的合成代谢途径,微生物合成柚皮苷、橙皮苷、圣草次苷等类黄酮的研究进展及技术思路,对宿主菌代谢负荷大、基因表达效率偏低、碳通量流向不平衡等问题,提出优化宿主菌株选择、微生物共培养、表达体系优化及碳通量重定向等解决方案,以期对目前柑橘类黄酮的微生物合成研究提供参考。
关键词 柑橘;类黄酮;微生物合成
柑橘是世界上第一大水果,含有丰富的类黄酮化合物等功能活性成分,是人类摄取多酚类化合物的重要来源之一[1]。类黄酮作为多酚类化合物的典型代表,具有十分重要的功能作用:一方面,在植物生长发育过程中,类黄酮可以有效地提高植物的抗逆性,抵御多种生物和非生物胁迫,如紫外线、病虫害等[2-3];另一方面,在动物实验和人类疾病研究中发现,类黄酮具有抗氧化、抗病毒等作用,对心血管疾病、神经退行性疾病(阿尔茨海默症、帕金森症)、癌症、糖尿病等具有良好的预防和治疗效果[4-7]。基于此,类黄酮相关产品的开发与利用一直是食品、药品等行业的热点议题。柑橘类黄酮通常用作抗氧化剂、甜味剂、风味增强剂以及天然色素等[8]。
随着对柑橘类黄酮日益增长的市场需求,每提取1 t 类黄酮需消耗5.49 t 柑橘幼果(类黄酮含量按18.20%计)或117.65 t 柑橘皮渣(类黄酮含量按0.85%计),获得这些皮渣需要336.14 t 柑橘鲜果(按35%计),需要耕地面积12.81 hm2(按柑橘年产量26.25 t/hm2 计)[9-11],同时还需要使用大量化肥和农药。该方法投入高,消耗高,污染高且产出低,使柑橘类黄酮的大量生产受到限制。发展绿色环保的方法是亟需解决的关键技术问题。化学合成的方法涉及化学试剂的使用以及严苛的反应条件,容易产生溶剂残留,制得的类黄酮用于食品、保健品、化妆品等产品中容易引起安全问题。利用微生物合成柑橘类黄酮越来越受到关注。微生物合成类黄酮是利用合成生物学工具在微生物中异源合成的一种方法,具有环境友好,资源节约的优势,符合可持续性发展的应用前景,是目前国内外类黄酮合成领域的研究热点,相关研究也取得巨大的进展。本文就柑橘中常见类黄酮化合物的微生物合成进行综述,旨在为目前生物合成类黄酮所面临的技术挑战提供一些参考。
1 柑橘类黄酮化合物的合成代谢途径
类黄酮是酚类化合物的主要种类之一,是迄今为止植物中最常见的次生代谢产物。类黄酮化合物由15 个碳组成基本碳骨架结构,其结构特征是由3 个碳(C 环)连接两个苯环(A 环、B 环),被称为C6-C3-C6多酚类化合物[12]。类黄酮化合物主要包括黄烷酮类、黄酮醇类、黄酮类、花青素类、异黄酮类等,其中柑橘中主要的类黄酮化合物包括柚皮苷、橙皮苷、圣草次苷、山奈酚、槲皮素、多甲氧基黄酮、花青素、芹菜素等(表1)。
类黄酮在柑橘中的合成主要经过苯丙烷代谢途径,由多种酶在内质网膜上催化完成[13]。苯丙烷代谢途径由苯丙氨酸解氨酶(PAL)、肉桂酸4-羟基化酶(C4H)、4-酰基辅酶A 连接酶(4CL)分别催化3 个过程。首先,PAL 催化苯丙氨酸合成肉桂酸,肉桂酸经C4H 转化为对香豆酸,然后三磷酸腺苷、辅酶A 和4CL 将对香豆酸转化为对香豆酰辅酶A(合成C6-C3-C6 骨架的前体物质之一)。其次,另一个前体物质是丙二酰辅酶A,主要通过乙酰辅酶A 复合物作用乙酰辅酶A 生成,然后3 分子的丙二酰辅酶A 和1 分子4-酰基辅酶A 在查尔酮合酶(CHS)作用下缩合生成柚皮素查尔酮,进一步通过查尔酮异构酶(CHI)催化,闭环形成柚皮素。最后,柚皮素经甲基化、酰基化、糖基化等修饰生成不同种类的柑橘类黄酮化合物[13-14](图1)。
表1 柑橘中主要类黄酮种类
Table 1 The main flavonoids in citrus


图1 柑橘类黄酮的合成代谢途径
Fig.1 Biosynthesis pathway network of flavonoids in citrus
注:PAL:苯丙氨酸解氨酶;C4H:肉桂酸4-羟基化酶;4CL:4-酰基辅酶A 连接酶;CHS:查尔酮合酶;CHI:查尔酮异构酶;FNS:黄酮合酶;F3H:类黄酮3 羟化酶;F3’H:类黄酮3’羟化酶;FLS:黄酮醇合酶;ANS:花青素合酶;FOMT:类黄酮-O-甲基转移酶;OMTs:O-甲基转移酶。
2 柑橘类黄酮化合物的微生物合成研究进展
2.1 黄烷酮类
2.1.1 柚皮苷 柚皮苷,全称柚皮素-7-O-新橙皮糖苷,是一种广泛存在于柚、葡萄柚和酸橙中的黄烷酮化合物,既可作为风味改良剂、天然色素、苦味剂以及新型甜味剂的原料被应用于食品行业,又具有预防心血管疾病、癌症、骨关节病等多种疾病的生理活性[9]。柚皮素(5,7,4’-三羟基黄烷酮)是柚皮苷的苷元,可通过7-O-葡萄糖苷转移酶和鼠李糖基转移酶合成柚皮苷[15]。目前,柚皮苷主要从柑橘中提取,有关微生物合成柚皮苷尚未见研究报道。同时,国内外大量研究主要聚焦于柚皮素的微生物合成,是微生物合成最多的类黄酮之一。作为合成柚皮苷的苷元,详细解析微生物合成柚皮素的过程,可为柚皮苷的微生物合成提供研究基础。
最早关于柚皮素的微生物合成是2003年Hwang 等[16]在大肠杆菌中组装了3 个合成黄烷酮的特异性基因:来自红酵母的RrPAL、腔隙链霉菌A3(2)的ScCCL 和甘草的GeCHS,每个基因前的T7 启动子和核糖体结合位点的数目不同,并分别以苯丙氨酸和酪氨酸为底物成功合成了两种黄烷酮,即松属素和柚皮素。随后不断有学者通过获取不同来源的酶,利用不同的底物在不同的平台微生物中构建代谢通路,从而异源合成柚皮素。
以大肠杆菌为平台微生物,利用不同的底物合成柚皮素。Watts 等[17]将来自荚膜梭菌的编码酪氨酸解氨酶基因TAL 和来自拟南芥的4CL、CHS导入大肠杆菌中,将葡萄糖作为底物成功合成了20.8 mg/L 柚皮素。Santos 等[18]将来自糯米的RgTAL、红薯的Pc4CL1、杂交稻的PhCHS、芸苔的MsCHI 以及三叶草根瘤菌的matB、matC 导入大肠杆菌中,以葡萄糖为底物成功合成了84 mg/L 柚皮素。Wu 等[19]构建了相同的重组大肠杆菌,并通过对重组菌株中心代谢通路进行精细调控,最终合成了421.6 mg/L 柚皮素。除了以葡萄糖为底物外,也有利用氨基酸(如L-酪氨酸)和苯丙素(如对香豆酸) 作为底物进行柚皮素的微生物合成。Miyahisa 等[20]以L-酪氨酸为底物,将来自刺毛甘草的CHS、龙眼草的PlCHI 构建到大肠杆菌中,最终合成57 mg/L 的柚皮素。而以对香豆酸为底物时,将不同来源的基因导入大肠杆菌中,合成的柚皮素含量达到474.2 mg/L[21]。
以酿酒酵母作为平台微生物,利用不同的底物合成柚皮素。Koopman 等[22]以葡萄糖为底物,将来自拟南芥的4CL、CHS1、CHI1、C4H、PAL1、CPR,来自荚膜梭菌的TAL1 构建到酿酒酵母中,并在2 L 发酵罐中扩大培养,成功合成了112.9 mg/L 柚皮素。焦亭亭等[23]利用启动子和拷贝数控制柚皮素合成关键基因,以对香豆酸为底物合成柚皮素235.9 mg/L。
除了以大肠杆菌和酿酒酵母为平台微生物外,也有学者以委内瑞拉链霉菌、产油酵母为平台微生物成功合成了柚皮素。Park 等[24]将来自拟南芥的AtCHS 和AtCHI 导入委内瑞拉链霉菌中,并以对香豆酸为底物合成了35.6 mg/L 柚皮素。Lv等[25]在筛选得到的产油酵母中构建柚皮素合成途径,以葡萄糖为底物成功合成了252.4 mg/L 柚皮素。
目前,微生物合成柚皮素的产量处于较低水平。以廉价碳源葡萄糖作为底物,柚皮素产量为421.6 mg/L,以成本较高的对香豆酸为底物合成柚皮素的产量为474.2 mg/L。结合现有研究分析,导致微生物合成柚皮素产量偏低的原因可能是途径基因,如CHI 等基因表达效率较低以及重组菌株中碳通量较少的流向柚皮素合成途径,导致碳通量分配不平衡。后期可通过引入强启动子来提高途径基因的表达效率以及运用新的合成生物学工具对重组菌株的碳通量进行精准调控,可望提高柚皮素的产量,为进一步对微生物高产柚皮苷奠定理论和技术基础。
2.1.2 橙皮苷 橙皮苷、橙皮素(橙皮苷苷元)是两种具有多种生理活性功能的柑橘类黄酮化合物。近10年来,有关这些化合物的生物活性及其分子机制研究方面发表了大量的论文[26]。橙皮苷、橙皮素具有神经保护作用,可通过清除自由基,降低Ca2+水平和半胱氨酸蛋白酶-3 活性等途径来保护细胞免受H2O2 诱导的细胞毒性[27];抗焦虑、抗惊厥[27]和镇静作用[28]、抗抑郁作用[29]以及提高认知功能[30]等生理活性。
橙皮苷主要从柑橘幼果中提取,而橙皮素是以橙皮苷为原料,通过化学方法水解芸香糖基后得到的产物。目前,较多类黄酮以橙皮苷为原料,通过化学半合成的方法合成[31-32]。大量使用橙皮苷增加了柑橘的消耗,对环境造成很大的影响。目前,关于微生物合成橙皮苷及其苷元的研究几乎未见报道,亟待补充和深入研究,为合成橙皮苷及其苷元的下游物质,如新橙皮苷等类黄酮提供技术支撑。
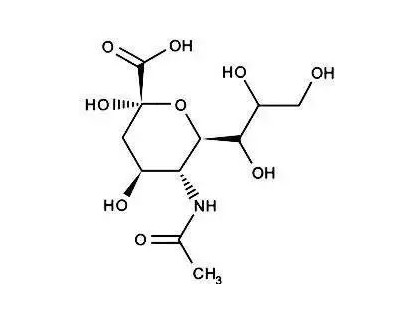
2.1.3 圣草次苷 圣草次苷(圣草素7-O-β-芸香糖苷)广泛存在于柑橘等植物中,具有较强的抗氧化、降血脂、抗肿瘤活性,在预防和改善氧化应激、高血脂症、心脑血管疾病以及癌症中起重要作用[33-38]。在柑橘类黄酮代谢途径中,首先通过葡萄糖合成圣草素,圣草素进一步经7-O-葡萄糖苷转移酶和1,6-鼠李糖基转移酶合成圣草次苷[15]。目前,微生物合成圣草次苷的研究几乎未见报道,且其难点之一是合成圣草素。弄清圣草素合成途径可为圣草次苷的微生物合成提供技术参考。
前期许多研究主要以咖啡酸为底物,在大肠杆菌中合成圣草素。Leonard 等[39]通过过表达大肠杆菌中来自黄檀的4CL、矮牵牛的CHS 以及紫花苜蓿的CHI,并以咖啡酸为底物合成了11 mg/L 圣草素;将来自三叶草根瘤菌的matB 和matC 导入该重组大肠杆菌中,圣草素的产量提高了近5倍[40];对该重组大肠杆菌的中心代谢网络和类黄酮合成途径进行精准调控,最终合成了114 mg/L 圣 草 素[41]。
除了以咖啡酸为底物外,研究人员也在探索通过苯丙烷代谢途径来合成圣草素,然而由于合成圣草素的关键酶F3’H 属于细胞色素P450 单加氧酶家族,在原核生物中的表达多与细胞膜结合形成包涵体,很难得到有效的可溶性表达,同时在原核生物中也缺少该类酶的辅酶因子,因此阻碍了原核生物以L-酪氨酸为底物成功合成圣草素。直到2014年,Zhu 等[42]将来源非洲菊的F3’H和长春花的细胞色素P450 还原酶的N 端膜结合序列进行截短和修饰,然后将二者进行有效融合,首次成功地以L-酪氨酸为底物合成了107 mg/L圣草素。2016年,周天山[43]将来源于茶树的F3’H和拟南芥的ATR(ATR1、ATR2)进行融合,也成功实现了微生物合成圣草素。2019年,Lv 等[25]以产油酵母作为宿主菌株,以葡萄糖为底物从头合成了134.2 mg/L 圣草素。
微生物成功合成圣草素,为圣草次苷的合成奠定了基础,同时也为合成其它类黄酮所依赖的细胞色素P450 单加氧酶在原核生物中的成功表达提供了技术参考。目前,圣草素途径基因如F3’H在大肠杆菌中的表达效率偏低。考虑到来源于真核生物的F3’H 的表达需要内质网膜的参与,因此,选择酿酒酵母等真核生物作为宿主菌株可能对增加F3’H 表达效率以及提高圣草素的产量起重要作用。同时,圣草素对菌体的生长有一定的抑制作用,通过研究相关膜的转运蛋白可提高圣草素的转运速率,减轻对宿主菌的抑制作用,对改造工程菌具有重要的指导意义。
2.2 黄酮醇类
2.2.1 山奈酚 山奈酚是一种广泛分布于柑橘等植物中的黄酮醇类化合物。流行病学研究发现,食用含山奈酚的食物与降低患心血管疾病和某些癌症的风险之间存在显著正相关,同时山奈酚在预防或治疗疾病中有明显的作用,如神经退行性疾病、传染病、焦虑症、过敏、糖尿病、骨质疏松症等[44]。山奈酚具有被开发成新药的潜力。目前,关于微生物合成山奈酚方面的研究相对较少。Miyahisa 等[45]以L-酪氨酸为底物,将来自红酵母的PAL、腔隙链霉菌A3(2)的ScCCL,刺毛甘草的CHS,黄花菜的CHI,红松的FS1,柑橘的F3H 和FLS 以及谷氨酸棒状杆菌的accBC、dtsR1 导入大肠杆菌中,成功合成了15.1 mg/L 山奈酚。Trantas等[46]将来自毛果假单胞菌和三角海棠的PAL、CPR,大豆的C4H、4CL、CHS、CHI、F3H 以及结核杆菌的FLS 导入酿酒酵母中,以苯丙氨酸为底物,合成了1.3 mg/L 山奈酚。Leonard 等[47]将来自红松的Pc4CL-2、拟南芥的FLS1、家蝇的MdF3H 以及来自蔷薇的融合蛋白F3’5’H 和CPR 导入大肠杆菌中,并分别以对香豆酸、柚皮素为底物合成了0.2 mg/L、0.9 mg/L 山奈酚。
综上研究发现,微生物合成山奈酚的产量偏低,主要原因可能是催化该途径的关键酶如FLS在宿主菌中异源表达效率偏低。此外,现阶段微生物合成山奈酚的研究较不完善,缺乏以葡萄糖等廉价碳源为底物合成山奈酚的研究。后续对微生物合成山奈酚的研究可能需要着重关注途径基因的表达效率以及以廉价碳源为底物合成山奈酚等方面的问题。
2.2.2 槲皮素 槲皮素是人们日常饮食中最常见的黄酮醇类化合物,每日平均摄入量可达13mg[48]。大量研究发现,槲皮素具有多种生物学特性:可直接作为自由基清除剂防止DNA、蛋白质和细胞膜损伤[49],具有抗炎作用[50]及抗肿瘤活性等[51]。目前,槲皮素已在大肠杆菌、酿酒酵母中成功合成。Leonard 等[46]将来自薯蓣的Pc4CL-2、FLS1、杂交稻的PhCHS 和PhCHI、家蝇的MdF3H 以及玫瑰F3’5’H 和CPR 的融合蛋白导入大肠杆菌中,分别以对香豆酸和圣草素为底物,合成了0.05 mg/L和1.1 mg/L 槲皮素。Trantas 等[47]将PAL、C4H、4CL、CHS、CHI、F3H、F3’H 和FLS 导入酿酒酵母中,并以柚皮素、对香豆酸为底物分别合成了0.38 mg/L 和0.26 mg/L 槲皮素。除此之外,Marín 等[52]首次在放线菌中构建了槲皮素合成代谢途径,从头合成了0.028~0.102 mg/L 槲皮素,这为除大肠杆菌和酿酒酵母外其它微生物成功合成槲皮素提供了研究借鉴。
微生物合成槲皮素相比柚皮素等其它类黄酮的研究较少,且通过现有技术合成的槲皮素产量较低。造成这种结果的原因之一可能是槲皮素合成代谢途径较长且较为复杂,使重组菌株代谢负荷过大,降低了槲皮素的产量。后续研究应从减轻重组菌株代谢负荷出发,引入多种合成生物学工具或改变微生物培养模式,可提高微生物合成槲皮素的产量。
2.3 多甲氧基黄酮类
甲基化是许多次级代谢产物后修饰的一种常见现象,植物来源的次生代谢产物特别是类黄酮化合物被S-腺苷-L-蛋氨酸依赖的咖啡酰辅酶A-O-甲基转移酶所甲基化。不同O-甲基转移酶如POMT-7、SaOMT-2、ROMT-9、SOMT-2 以 及SpOMT2884 催化黄酮醇类、黄烷酮类、黄酮类和异黄酮类合成不同的甲氧基黄酮。多甲氧基黄酮广泛存在于柑橘果皮中,与类黄酮苷元相比,甲基化的类黄酮生物利用度明显提高[53]。川陈皮素是一种具有显著的抗氧化、抗炎症,提高免疫力,降低心血管疾病风险等生物学活性的多甲氧基黄酮[54]。目前,川陈皮素等多甲氧基黄酮主要从柑橘中提取,微生物合成多甲氧基黄酮的研究几乎未见报道。考虑到多甲氧基黄酮较强的生理活性,利用合成生物学工具将不同种类的OMTs 导入大肠杆菌、酵母菌等宿主菌中,可实现微生物合成多甲氧基黄酮。
2.4 花青素类
许多研究证明,在大肠杆菌、酿酒酵母等宿主菌中构建花青素合成途径,以肉桂酸、柚皮素、咖啡酸、葡萄糖或圣草素等不同物质为底物,均能成功合成花青素[40,55-58]。由于合成花青素代谢途径较长且过于复杂,大大增加了宿主菌的代谢负担,因此,多种研究策略如增加尿苷二磷酸(UDP)-葡萄糖利用率,重定向碳通量以及优化培养条件等用以提高花青素的产量[57]。除此之外,近年来以多种微生物共培养的方式合成花青素的研究出现。如Jones 等[59]以4 种大肠杆菌共培养的方式成功合成了9.5 mg/L 天竺葵素3-O-葡萄糖苷;Akdemir等[60]将重组大肠杆菌进行共培养成功合成了吡喃花青素。这种微生物共培养的方法能有效地减轻单一微生物培养的代谢负担,为微生物合成花青素提供了新的技术思路。
2.5 芹菜素
芹菜素(4,5,7-三羟基黄酮)是一种广泛分布于水果、蔬菜的黄酮类化合物。前期大量研究发现,芹菜素具有抗氧化、抗炎、抗肿瘤等多种生理活性[61]。目前,芹菜素已在大肠杆菌、委内瑞拉链霉菌中成功合成。Miyahisa 等[62]以L-酪氨酸为底物,将来自于红酵母的PAL、腔隙链霉菌A3(2)的ScCCL、甘草的CHS、野葛的CHI、薯蓣的FS1 以及谷氨酸棒状杆菌的accBC 和dtsR1 导入大肠杆菌中,最终合成13mg/L 的芹菜素。Leonard 等[63]以对香豆酸为底物,将来自于三叶草根瘤菌的matB和matC、薯蓣的4CL 和FS1、矮牵牛的CHS、芸苔的CHI 导入大肠杆菌中,并通过添加浅蓝菌素来抑制脂肪酸的代谢,从而合成了110 mg/L 的芹菜素。Park 等[24]将来自拟南芥的AtCHS 和AtCHI、薯蓣的PcFS1 导入委内瑞拉链霉菌中,并以肉桂酸为底物合成了15.3 mg/L 的芹菜素。
目前,微生物合成芹菜素的产量较低,主要原因可能是重组菌株中碳通量主要流向中心代谢途径而较少流向芹菜素合成途径,最终导致碳通量分配不平衡。后期可以通过合成生物学工具如成簇的规律间隔的短回文重复序列(Clustered regularly interspaced short palindromic repeats,CRISPR)技术对芹菜素合成途径进行精准调控,可望使微生物合成芹菜素产量较低的问题得到解决。
3 存在的问题
利用不同的合成生物学工具对重组菌株进行改造,在提高类黄酮产量方面的研究已取得较好的进展。然而与微生物合成的其它天然产物相比,微生物合成柑橘类黄酮产量偏低,需要使用多种合成生物学工具来进一步提高产量。主要存在的问题归结为以下3 点:
1) 重组菌株代谢负荷大。合成途径的功能和整体的转化效率取决于很多因素,而当重组代谢途径较长且过于复杂,单一菌株不能满足途径需求时,就会出现菌体代谢负荷大,降低目标产物产量的问题[64]。
2) 基因表达效率偏低。微生物合成类黄酮是依赖转入宿主菌中的表达载体所合成的酶完成,这些酶的含量受到基因表达效率的影响。在微生物合成过程中,可能会出现单个基因表达效率低,多基因协同表达时限速酶基因表达受到抑制,外源序列含有较多宿主菌的稀有密码子,导致表达受阻以及缺少非翻译区(UTR)导致核酸稳定性不足等问题。
3) 中心代谢途径和类黄酮合成途径之间碳通量的平衡。中心代谢途径是微生物维持生活所必需,绝大部分碳通量均流向中心代谢网络以维持微生物的正常生活。在提高类黄酮产量的同时,一方面在确保微生物正常的生活情况下,尽可能地减少碳通量流向中心代谢网络;另一方面要尽可能增加类黄酮合成途径的碳通量,如何达到平衡,从而提高类黄酮产量,是一直以来需要解决的技术问题。
4 应对策略
4.1 宿主菌株的选择
微生物合成类黄酮首要的技术问题是宿主菌株的选择。一直以来,合成类黄酮的微生物主要分为两类:一类是原核生物,如大肠杆菌,其具有生长快,遗传背景清楚,染色体易操作等优势,在许多氨基酸等物质的微生物合成中被广泛应用。然而,大肠杆菌缺乏与类黄酮化合物合成相关的细胞器,如细胞色素P450 单加氧酶只有与内质网膜结合才能发挥重要的作用[65],因此,在大肠杆菌中依赖于细胞器表达的酶较难实现有效表达。另一类是酿酒酵母等真核生物,具有和高等真核生物相同的细胞器,能满足那些来源于真核生物的酶的表达。然而,与原核生物相比,真核生物生长速度慢,操作难度较大且遗传背景更为复杂。目前,微生物合成类黄酮的宿主菌株主要选择大肠杆菌和酿酒酵母,其它种类微生物的研究相对较少。
丙二酰辅酶A 是类黄酮合成中重要的前体物质,因主要参与脂肪酸的代谢途径而被大量消耗。大量研究主要通过引入、调控相关代谢基因来提高宿主菌中丙二酰辅酶A 的含量。而Lv 等[25]从优化宿主菌选择的角度出发,筛选脂肪酸合成丰富的产油酵母作为宿主菌株,通过提高丙二酰辅酶A 的含量,增加类黄酮的产量。除此之外,链霉菌也被认为是合成类黄酮化合物重要的平台微生物[66]。
4.2 微生物共培养
当重组代谢途径较长且过于复杂,单一菌株不能满足途径需求时,就会出现菌体代谢负担的问题[64]。为了克服微生物代谢负担的局限性,将复杂而较长的合成途径分配到不同的菌株,减轻菌体代谢负担来提高共培养体系的生产性能方面的研究在近年来取得重大的进展[59,67-71]。相比单一微生物传统的培养模式,微生物共培养可减轻菌体代谢负担[72],避免中间物质对底物的反馈抑制作用[73-74],为不同酶特别是来自于真核微生物的酶的表达提供了最适的表达环境[71]。相比两步发酵模式,可避免菌体转移造成的污染[75],通过菌体间的共生关系去除不需要的副产物,提高目标产物产量[76]。
微生物共培养是代谢工程的一个新兴领域,对微生物共培养合成类黄酮的研究尚处于起步阶段。虽然,这种方法较传统培养模式具有一定的优势,但仍存在如菌株间的亲和性、底物的竞争、代谢中间体的转运等问题[72]。采用合成生物学和代谢工程的手段来解决微生物共培养所带来的问题,可望将来开发出适用于合成类黄酮的微生物共培养体系,为实现工业化生产提供技术支撑。
4.3 优化表达体系

图2 微生物共培养示意图 (a)两种相同微生物共培养;(b)两种不同微生物共培养;(c)多种微生物共培养)[72]
Fig.2 Schematic representation of artificial consortium for bioproductions (a) Co-cultivation comprising strains of the same species,(b) Co-cultivation comprising strains from different species and (c) Co-cultivation comprising mixed strains i.e.polyculture[72]
优化表达载体是提高异源基因表达效率的重要手段。在微生物合成柑橘类黄酮的研究中发现,类黄酮合成基因在宿主菌中可能由于DNA 转录水平低,编码基因的密码子与宿主菌偏好性不同以及转录后mRNA 在宿主菌内不稳定等问题,导致基因的表达效率偏低,最终使柑橘类黄酮的产量偏低。需要对表达载体进行优化以提高基因的表达效率,主要从启动子优化,基于限速酶的表达效率调节,密码子优化以及UTR 优化入手。
不同启动子的转录效率不同,选择适合宿主菌的强启动子有助于提高目的基因的表达率[77]。选择启动子时主要考察3 点:1) 启动子具有较强的转录活性;2)在低转录水平时,启动子能表现出转录活性和可诱导性;3) 当表达的蛋白或次生代谢物对宿主菌株产生毒性时,可通过控制启动子的转录活性来调节基因的表达。此外,在序列中通过插入增强子可以提高启动子的转录活性。优化启动子能显著提高目的基因的表达效率,然而表达效率过高并不适合反应的进行。当多个基因协同表达时,非限速酶表达效率过高可能会影响限速酶的正常表达。下调非限速酶的基因表达可减轻菌体代谢负担,提高限速酶的表达。由于微生物合成柑橘类黄酮的途径较长,所以通过不同强启动子对不同酶的表达效率进行调控,对优化柑橘类黄酮的表达体系具有重要意义。
密码子优化也是提高基因表达效率的重要方法。不同微生物对核苷酸序列的偏好性不同,导致对基因的表达效率存在差异。柑橘类黄酮合成基因主要来自植物等高等生物中,而类黄酮的微生物合成则在大肠杆菌、酵母菌等低等生物中进行。考虑到宿主菌对不同密码子的偏好性不同,在导入类黄酮合成途径基因之前,需经适合于大肠杆菌或酿酒酵母等微生物的密码子优化,避免稀有密码子,从而有效提高目的基因在宿主菌中的表达效率[78]。
位于mRNA 上游的5’端和下游的3’端UTR在mRNA 降解过程中的重要作用,可能对mRNA的稳定性产生影响。在构建柑橘类黄酮的表达载体时,常常仅包含启动子、目的基因的编码区(Coding sequence,CDS)等“有效”的基因序列,而不包含两端UTR 的基因序列,这使编码柑橘类黄酮合成相关酶的mRNA 在宿主菌内可能发生降解。在对表达载体进行优化时,可以考虑对UTR进行优化以提高目的蛋白的表达效率[79]。
4.4 碳通量重定向
丙二酰辅酶A 的供给问题一直以来被认为是微生物合成类黄酮的主要瓶颈问题之一。丙二酰辅酶A 是脂肪酸合成的重要中间物质,在脂肪酸代谢途径中被利用消耗。为了避免丙二酰辅酶A的消耗,引入多种研究策略:一是过表达乙酰辅酶A 羧化酶复合物编码基因、生物素连接酶基因、乙酸同化基因,可使工程菌合成类黄酮的产量能提高183%~1 379%[39];二是在培养基中添加浅蓝菌素来抑制脂肪酸代谢途径基因,可使类黄酮含量提高900%[80];三是导入三叶草根瘤菌丙二酰辅酶A 途径,通过外源添加丙二酸盐可使丙二酰辅酶A 含量提高近两倍[81]。
这些策略的使用往往对菌体的生长造成不利影响,如高剂量浅蓝菌素会对细胞的生长产生毒害作用,从而会降低类黄酮的产量和细胞的生长率[80],因此利用合成生物学工具进行菌株改造尤为重要。研究表明,RNA 介导的调控机制对碳通量的精细调控十分重要[82],然而RNA 干扰(RNAi)技术在细菌中存在效率低的问题[83-84]。成簇的规律间隔的短回文重复序列干扰 (Clustered regularly interspaced short palindromic repeats interference,CRISPRi)系统可以将sgRNA(small guide RNA)定向到目标基因的非模板DNA 链的不同区域,从而方便地对细菌基因的表达水平进行调节[85],这为调控类黄酮合成基因的表达提供了可能性。Wu 等[86]采用CRISPRi 系统来精细调控大肠杆菌的中心代谢途径,使碳通量尽可能高效地流向丙二酰辅酶A 合成途径,并在多基因的协同表达下,最终使柚皮素的产量提高到421.6 mg/L。此外,其它限速酶也可能是导致类黄酮产量偏低的原因,需要采用CRISPR 系统或其它合成生物学工具来平衡碳通量,从而提高类黄酮的产量。
5 展望
近年来,分子生物学、系统和合成生物学工具的应用为大肠杆菌和酿酒酵母合成类黄酮化合物奠定了理论和技术基础。然而,宿主菌利用廉价碳源作为底物合成类黄酮化合物的产量偏低,是工厂大规模生产和类黄酮在商业应用中的限制因素之一。限速酶的鉴定,类黄酮合成途径基因的精准调控和优化,宿主菌中平衡碳通量的技术难度大。药理活性明显高于头孢呋辛类药物的橙皮素[87]、新橙皮苷、多甲氧基黄酮、香叶木素等类黄酮的微生物合成研究尚处于起步阶段。
随着生命科学研究的快速发展,结合代谢工程、系统和合成生物学工具以及微生物共培养模式用于菌株设计、途径构建和优化,可望使微生物合成类黄酮产量偏低的问题得到解决,也为微生物合成其它植物功效成分提供参考方法和模式。此外,微生物合成类黄酮可以改变天然产物从植物中提取的传统模式,为类黄酮的大量获得提供绿色、可持续的替代方案。可减轻种植柑橘等果树需要大量土地资源的压力,减少化肥、农药的使用;还可满足人们日益增长的健康生活水平对柑橘类黄酮等功效成分的需求,为我国环境友好、资源节约型社会的建设以及大健康产业的发展提供科技支撑。
ta-name="参考文献">参 考 文 献
[1]DURAND-HULAK M,DUGRAND A,DUVAL T,et al.Mapping the genetic and tissular diversity of 64 phenolic compounds in Citrus species using a UPLC-MS approach[J].Annals of Botany,2015,115(5):861-877.
[2]TREUTTER D.Significance of flavonoids in plant resistance:a review[J].Environmental Chemistry Letters,2006,4(3):147.
[3]WINKEL -SHIRLEY B.Biosynthesis of flavonoids and effects of stress[J].Current Opinion in Plant Biology,2002,5(3):218-223.
[4]XIAO J,TUNDIS R.Natural products for A lzheimer’s disease therapy:basic and application[J].Journal of Pharmacy and Pharmacology,2013,65(12):1679-1680.
[5]SHAO R,XIAO J.Natural products for treatment of Alzheimer’s disease and related diseases:understanding their mechanism of action[J].Current Neuropharmacology,2013,11(4):337.
[6]HEIM K E,TAGLIAFERRO A R,BOBILYA D J.Flavonoid antioxidants:chemistry,metabolism and structure-activity relationships[J].The Journal of Nutritional Biochemistry,2002,13(10):572-584.
[7]DING X,OUYANG M A,LIU X,et al.Acetylcholinesterase inhibitory activities of flavonoids from the leaves of Ginkgo biloba against brown planthopper[J].Journal of Chemistry,2013.doi:10.1155/2013/645086.ID 645086.
[8]单杨.柑桔加工技术研究与产业化开发[J].中国食品学报,2006,6(1):423-428.
[9]单杨.现代柑橘工业[M].北京:化学工业出版社,2013:20-22.
[10]江萍.柑橘幼果中主要功能性成分分析及抗氧化作用的研究[D].杭州:浙江大学,2008.
[11]张菊华,李志坚,单杨,等.柑桔鲜果皮中类黄酮含量比较与分析[J].中国食品学报,2015,15(5):233-240.
[12]CORRADINI E,FOGLIA P,GIANSANTI P,et al.Flavonoids:chemical properties and analytical methodologies of identification and quantitation in foods and plants[J].Natural Product Research,2011,25(5):469-495.
[13]PANDEY R P,PARAJULI P,KOFFAS M A,et al.Microbial production of natural and non-natural flavonoids:pathway engineering,directed evolution and systems/synthetic biology[J].Biotechnology Advances,2016,34(5):634-662.
[14]陈坚,周胜虎,吴俊俊,等.微生物合成黄酮类化合物的研究进展[J].食品科学技术学报,2015,33(1):1-5.
[15]陈嘉景,彭昭欣,石梅艳,等.柑橘中类黄酮的组成与代谢研究进展[J].园艺学报,2016,43(2):384-400.
[16]HWANG E I,KANEKO M,OHNISHI Y,et al.Production of plant-specific flavanones by Escherichia coli containing an artificial gene cluster[J].Applied and Environmental Microbiology,2003,69(5):2699-2706.
[17]WATTS K T,LEE P C,SCHMIDT-DANNERT C.Exploring recombinant flavonoid biosynthesis in metabolically engineered Escherichia coli[J].Chembiochem,2004,5(4):500-507.
[18]SANTOS C N S,KOFFAS M,STEPHANOPOULOS G.Optimization of a heterologous pathway for the production of flavonoids from glucose[J].metabolic Engineering,2011,13(4):392-400.
[19]WU J,ZHOU T,DU G,et al.Modular optimization of heterologous pathways for de novo synthesis of (2S)-naringenin in Escherichia coli[J].PLoS One,2014,9(7):e101492.
[20]MIYAHISA I,KANEKO M,FUNA N,et al.Efficient production of (2S)-flavanones by Escherichia coli containing an artificial biosynthetic gene cluster[J].Applied Microbiology and Biotechnology,2005,68(4):498-504.
[21]XU P,RANGANATHAN S,FOWLER Z L,et al.Genome-scale metabolic network modeling results in minimal interventions that cooperatively force carbon flux towards malonyl-CoA[J].metabolic Engineering,2011,13(5):578-587.
[22]KOOPMAN F,BEEKWILDER J,CRIMI B,et al.De novo production of the flavonoid naringenin in engineered Saccharomyces cerevisiae[J].Microbial Cell Factories,2012,11(1):155.
[23]焦亭亭,周景文,徐沙.柚皮素合成关键基因表达水平对目标产物积累水平的量化影响[J].生物工程学报,2019,35(7):1256-1265.
[24]PARK S R,AHN M S,HAN A R,et al.En hanced flavonoid production in Streptomyces venezuelae via metabolic engineering [J].Journal of Microbi ology and Biotechnology,2011,21(11):1143-1146.
[25]LV Y,KOFFAS M,ZHOU J,et al.Optimizing oleaginous yeast cell factories for flavonoids and hydroxylated flavonoids biosynthesis[J].BioRxiv,2019.doi.org/10.1101/614099.
[26]GARG A,GARG S,ZANEVELD L,et al.Chemistry and pharmacology of the citrus bioflavonoid hesperidin[J].Phytotherapy Research,2001,15(8):655-669.
[27]WASOWSKI C,LOSCALZO L M,HIGGS J,et al.Chronic intraperitoneal and oral treatments with hesperidin induce central nervous system effects in mice[J].Phytotherapy Research,2012,26(2):308-312.
[28]VISWANATHA G,SHYLAJA H,SANDEEP RAO K,et al.Hesperidin ameliorates immobilization -stress-induced behavioral and biochemical alterations and mitochondrial dysfunction in mice by modulating nitrergic pathway [J].ISRN Pharmacology,2012.doi:10.5402/2012/479570.ID 479570.
[29]DonATO F,DE GOMES M G,GOES A T R,et al.Hesperidin exerts antidepressant-like effects in acute and chronic treatments in mice:Possible role of L-arginine-NO-cGMP pathway and BDNF levels[J].Brain Research Bulletin,2014,104:19-26.
[30]ANTUNES M S,GOES A T,BOEIRA S P,et al.Protective effect of hesperidin in a model of Parkinson’s disease induced by 6 -hydroxydopamine in aged mice[J].Nutrition,2014,30(11/12):1415-1422.
[31]黄爱玲,张义龙,黄成,等.橙皮苷和橙皮素衍生物的合成及生物活性研究进展[J].药学进展,2018,42(7):527-536.
[32]单杨,李高阳,汪秋安,等.橙皮苷半合成5 种生物活性黄酮类化合物[J].有机化学,2008,28(6):99-103.
[33]HAJIMAHMOODI M,MOGHADDAM G,MOUSAVI S M,et al.Total antioxidant activity,and hesperidin,diosmin,eriocitrin and quercetin contents of various lemon juices[J].Tropical Journal of Pharmaceutical Research,2014,13(6):951-956.
[34]FERREIRA P S,SPOLIDORIO L C,MANTHEY J A,et al.Citrus flavanones prevent systemic inflammation and ameliorate oxidative stress in C57BL/6J mice fed high-fat diet[J].Food & Function,2016,7(6):2675-2681.
[35]MINATO K-I,MIYAKE Y,FUKUMOTO S,et al.Lemon flavonoid,eriocitrin,suppresses exercise-in duced oxidative damage in rat liver[J].Life Sciences,2003,72(14):1609-1616.
[36]HIRAMITSU M,SHIMADA Y,KUROYANAGI J,et al.Eriocitrin ameliorates diet -induced hepatic steatosis with activation of mitochondrial biogenesis[J].Scientific Reports,2014,4:3708.
[37]MIYAKE Y,SUZUKI E,OHYA S,et al.Lipidlowering effect of eriocitrin,the main flavonoid in lemon fruit,in rats on a high-fat and highcholesterol diet[J].Journal of Food Science,2006,71(9):S633-S637.
[38]WANG Z,ZHANG H,ZHOU J,et al.Eriocitrin from lemon suppresses the proliferation of human hepatocellular carcinoma cells through inducing apoptosis and arresting cell cycle[J].Cancer Chemotherapy and Pharmacology,2016,78(6):1143-1150.
[39]LEonARD E,LIM K H,SAW P N,et al.Engineering central metabolic pathways for high -level flavonoid production in Escherichia coli[J].Applied and Environmental Microbiology,2007,73 (12):3877-3886.
[40]LEonARD E,YAN Y,FOWLER Z L,et al.Strain improvement of recombinant Escherichia coli for efficient production of plant flavonoids[J].Molecular Pharmaceutics,2008,5(2):257-265.
[41]FOWLER Z L,GIKANDI W W,KOFFAS M A.Increased malonyl coenzyme A biosynthesis by tuning the Escherichia coli metabolic network and its application to flavanone production[J].Applied and Environmental Microbiology,2009,75(18):5831-5839.
[42]ZHU S,WU J,DU G,et al.Efficient synthesis of eriodictyol from L-tyrosine in Escherichia coli[J].Applied and Environmental Microbiology,2014,80(10):3072-3080.
[43]周天山.茶树类黄酮3′-羟基化酶功能分析及其在代谢工程中的应用[D].杨凌:西北农林科技大学,2016.
[44]M CALDERON-MonTANO J,BURGOS-MORÓN E,PÉREZ-GUERRERO C,et al.A review on the dietary flavonoid kaempferol [J].Mini Reviews in Medicinal Chemistry,2011,11(4):298-344.
[45]MIYAHISA I,FUNA N,OHNISHI Y,et al.Combinatorial biosynthesis of flavones and flavonols in Escherichia coli[J].Applied Microbiology and Biotechnology,2006,71(1):53-58.
[46]LEonARD E,YAN Y,KOFFAS M A.Functional expression of a P450 flavonoid hydroxylase for the biosynthesis of plant-specific hydroxylated flavonols in Escherichia coli[J].metabolic Engineering,2006,8(2):172-181.
[47]TRANTAS E,PANOPOULOS N,VERVERIDIS F.metabolic engineering of the complete pathway leading to heterologous biosynthesis of various flavonoids and stilbenoids in Saccharomyces cerevisiae [J].metabolic Engineering,2009,11(6):355-366.
[48]CAO J,ZHANG Y,CHEN W,et al.The relationship between fasting plasma concentrations of selected flavonoids and their ordinary dietary intake[J].British Journal of Nutrition,2010,103(2):249-255.
[49]LIMASSET B,LE DOUCEN C,DORE J C,et al.Effects of flavonoids on the release of reactive oxygen species by stimulated human neutrophils:Multivariate analysis of structure -activity relationships(SAR)[J].Biochemical Pharmacology,1993,46(7):1257-1271.
[50]COMALADA M,BALLESTER I,BAILON E,et al.Inhibition of pro-inflammatory markers in primary bone marrow-derived mouse macrophages by naturally occurring flavonoids:analysis of the structureactivity relationship [J].Biochemical Pharmacology,2006,72(8):1010-1021.
[51]LI Y,DUAN S,JIA H,et al.Flavonoids from tartary buckwheat induce G2/M cell cycle arrest and apoptosis in human hepatoma HepG2 cells[J].Acta Biochim Biophys Sin,2014,46(6):460-470.
[52]MARÍN L,GUTIÉRREZ-DEL-RÍO I,ENTRIALGO-CADIERNO R,et al.De novo biosynthesis of myricetin,kaempferol and quercetin in Streptomyces albus and Streptomyces coelicolor[J].PloS One,2018,13(11):e0207278.
[53]WEN L,JIANG Y,YANG J,et al.Structure,bioactivity,and synthesis of methylated flavonoids[J].Annals of the New York Academy of Sciences,2017,1398(1):120-129.
[54]张梦玲,李绮丽,李高阳,等.柑橘多甲氧基黄酮的来源及生物学作用[J].食品与机械,2019,35(1):213-236.
[55]YAN Y,CHEMLER J,HUANG L,et al.metabolic engineering of anthocyanin biosynthesis in Escherichia coli[J].Applied and Environmental Microbiology,2005,71(7):3617-3623.
[56]YAN Y,LI Z,KOFFAS M A.High-yield anthocyanin biosynthesis in engineered Escherichia coli[J].Biotechnology and Bioengineering,2008,100(1):126-140.
[57]LIM C G,WONG L,BHAN N,et al.Development of a recombinant Escherichia coli strain for overproduction of the plant pigment anthocyanin[J].Applied and Environmental Microbiology,2015,81 (18):6276-6284.
[58]ZHA J,KOFFAS M A.Production of anthocyanins in metabolically engineered microorganisms:current status and perspectives[J].Synthetic and Systems Biotechnology,2017,2(4):259-266.
[59]JonES J A,VERNACCHIO V R,COLLINS S M,et al.Complete biosynthesis of anthocyanins using E.coli polycultures[J].MBio,2017,8(3):e00621-617.
[60]AKDEMIR H,SILVA A,ZHA J,et al.Production of pyranoanthocyanins using Escherichia coli co-cultures[J].metabolic Engineering,2019,55:290-298.
[61]陈亭亭,杨培伟,张树辉.芹菜素抗肿瘤机制的研究进展[J].中国现代应用药学,2019,36(4):507-510.
[62]MIYAHISA,IKUO,FUNA,et al.Combinatorial biosynthesis of flavones and flavonols in Escherichia coli[J].Applied Microbiology & Biotechnology,2006,71(1):53-58.
[63]LEonARD E,YAN Y,FOWLER Z L,et al.Strain improvement of recombinant Escherichia coli for efficient production of plant flavonoids[J].Molecular Pharmaceutics,2008,5(2):257-265.
[64]WU G,YAN Q,JonES J A,et al.metabolic burden:cornerstones in synthetic biology and metabolic engineering applications[J].Trends in Biotechnology,2016,34(8):652-664.
[65]AYABE S -I,AKASHI T.Cytochrome P450s in flavonoid metabolism [J].Phytochemistry Reviews,2006,5(2/3):271-282.
[66]DELMULLE T,DE MAESENEIRE S L,DE MEY M.Challenges in the microbial production of flavonoids[J].Phytochemistry Reviews,2018,17(2):229-247.
[67]JonES J A,VERNACCHIO V R,SINKOE A L,et al.Experimental and computational optimization of an Escherichia coli co-culture for the efficient production of flavonoids[J].metabolic Engineering,2016,35:55-63.
[68]LIU Y,TU X,XU Q,et al.Engineered monoculture and co-culture of methylotrophic yeast for de novo production of monacolin J and lovastatin from methanol[J].metabolic Engineering,2018,45:189-199.
[69]SAINI M,CHEN M H,CHIANG C-J,et al.Potential production platform of n -butanol in Escherichia coli[J].metabolic Engineering,2015,27:76-82.
[70]TSOI R,WU F,ZHANG C,et al.metabolic division of labor in microbial systems[J].Proceedings of the National Academy of Sciences,2018,115(10):2526-2531.
[71]ZHANG H,WANG X.Modular co-culture engineering,a new approach for metabolic engineering[J].metabolic Engineering,2016,37:114-121.
[72]JAWED K,YAZDANI S S,KOFFAS M A.Advances in the development and application of microbial consortia for metabolic engineering[J].metabolic Engineering Communications,2019,e00095.
[73]PILLAI V C,SNYDER R O,GUMASTE U,et al.Effects of transient overexpression or knockdown of cytochrome P450 reductase on reactive oxygen species generation and hypoxia reoxygenation injury in liver cells[J].Clinical and Experimental Pharmacology and Physiology,2011,38(12):846-853.
[74]ZHOU K,QIAO K,EDGAR S,et al.Distributing a metabolic pathway among a microbial consortium enhances production of natural products[J].Nature Biotechnology,2015,33(4):377.
[75]GULERIA S,ZHOU J,KOFFAS M A.Nutraceuticals (vitamin C,carotenoids,resveratrol)[J].Industrial Biotechnology:Products and Processes,2017,4(10):309-336.
[76]BAYER T S,WIDMAIER D M,TEMME K,et al.Synthesis of methyl halides from biomass using engineered microbes[J].Journal of the American Chemical Society,2009,131(18):6508-6515.
[77]WU S M,FENG C,ZHONG J,et al.Enhanced production of recombinant nattokinase in Bacillus subtilis by promoter optimization[J].World Journal of Microbiology and Biotechnology,2011,27(1):99-106.
[78]DAI Z,CHEN Y,QI W,et al.Codon optimization increases human kallistatin expression in Escherichia coli [J].Preparative Biochemistry and Biotechnology,2013,43(1):123-136.
[79]MÄRTENS B,SHARMA K,URLAUB H,et al.The SmAP2 RNA binding motif in the 3′ UTR affects mRNA stability in the crenarchaeum Sulfolobus solfataricus[J].Nucleic Acids Research,2017,45(15):8957-8967.
[80]LIM C G,FOWLER Z L,HUELLER T,et al.High-yield resveratrol production in engineered Escherichia coli[J].Applied and Environmental Microbiology,2011,77(10):3451-3460.
[81]AN J H,KIM Y S.A gene cluster encoding malonyl-CoA decarboxylase (MatA),malonyl-CoA synthetase (MatB) and a putative dicarboxylate carrier protein (MatC) in Rhizobium trifolii:Cloning,sequencing,and expression of the enzymes in Escherichia coli [J].European Journal of Biochemistry,1998,257(2):395-402.
[82]LIANG J C,BLOOM R J,SMOLKE C D.Engineering biological systems with synthetic RNA molecules[J].Molecular Cell,2011,43(6):915-926.
[83]NAKASHIMA N,TAMURA T,GOOD L.Paired termini stabilize antisense RNAs and enhance conditional gene silencing in Escherichia coli [J].Nucleic Acids Research,2006,34(20):e138.
[84]GAGARINOVA A,EMILI A.Genome-scale genetic manipulation methods for exploring bacterial molecular biology[J].Molecular BioSystems,2012,8(6):1626-1638.
[85]QI L S,LARSON M H,GILBERT L A,et al.Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression[J].Cell,2013,152(5):1173-1183.
[86]WU J,DU G,CHEN J,et al.Enhancing flavonoid production by systematically tuning the central metabolic pathways based on a CRISPR interference system in Escherichia coli [J].Scientific Reports,2015,5:13477.
[87]HASSAN B A,HAMED F M,ALYASEEN F F.Phytochemical screened,characterization and antibacterial activity of hesperetin and hesperidin extracted and isolated from dried oranges peels[J].International Journal of Research in Pharmaceutical Sciences,2018,9(4):1362-1367.
Research Progress on the Biosynthesis of Flavonoids in Citrus
Shan Yang1,2,3 Liu Juan1,3 Wang Zhen1,3 Xiao Yecheng1,3
(1Fruit and Vegetable Processing,Quality and Safety Innovation Team of Ministry of Science and Technology of the People’s Republic of China,Changsha 410125 2Hunan Academy of Agricultural Sciences,Changsha 410125 3Longping Branch Graduate School,Hunan University,Changsha 410125)
Abstract Flavonoids are abundant in citrus and widely used in food,medicine,cosmetics,and other industries due to its various physiological activities.Flavonoids are mostly extracted from citrus and other plants,and a small amount is synthesized chemically or modified structurally.In recent years,the microbial method of constructing metabolism pathways in a host,such as Escherichia coli and Saccharomyces cerevisiae,has entered the research stage,which has sustainable application prospects due to its high safety,environmental protection.Collectively,this study briefly describes the synthesis of flavonoids in citrus and focuses on the research progress on the microbial synthesis of naringin,hesperidin,eriocitrin,etc.We also propose several problems with the heavy metabolic burden of the host,the low efficiency of gene expression,unreasonable distribution of carbon flux,and put forward solving methods including optimization of the host selection,microbial coculture,the expression system,and carbon flux.We hope to provide references for the current research on the microbial synthesis of flavonoids in citrus.
Keywords citrus;flavonoids;microbial synthesis
文章编号 1009-7848(2019)11-0001-13
doi:10.16429/j.1009-7848.2019.11.001
收稿日期:2019-11-06
基金项目:国家科技支撑计划项目(2012BAD31B02);国家“万人计划”项目(W01020247)
作者简介:单杨,男,1963年出生,博士,研究员E-mail:sy6302@sohu.com