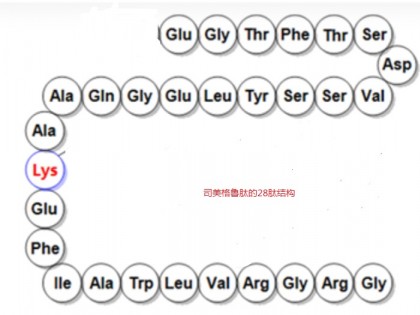
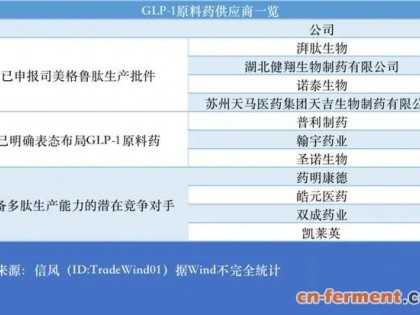
尽管目前的政策还不明朗,而且有可能会在生产中投入大量资金,不过药物生产商们还是希望尽快把包括单克隆抗体在内的各种生物仿制药推向临床。对于欧美仿制药生产商来说,抗体生物仿制药意味着几十亿美元的市场机遇。然而,对于原研药企来讲,如果他们的重磅炸弹级单克隆抗体药物失去专利保护,仿制药将会在市场上与之同台竞争,从而导致其收入下降。
在美国准备制定相应政策之时,欧洲某些地区已经为抗体和其他多种生物制品批准制定了相应的指导方针并予以实施。目前,欧洲已经批准了10多种生物仿制药,包括诺华山德士生产辉瑞研发的生长激素Genotropin(somatropin)仿制药Omnitrope以及安进的重组粒细胞集落刺激因子Neupogen(filgrastim)的仿制药Zarzio。
目前还没有哪一种生物仿制药的约束政策可以适用于抗体仿制药的生产,而且抗体仿制药生产商已经具有进行快速仿制的能力。单克隆抗体药物Rituxan生产者罗氏/基因泰克在其网站上称,由于生物制品的复杂性和不同生产过程导致的差异,每一种生物仿制药都应保证其足够的安全性和疗效,以及严格控制临床研究。
MedImmune公司认为:“生物仿制药一旦获得批准,FDA的风险管理计划应该保证产品上市后安全性和免疫原性受到严格监控。如果生物仿制药的临床资料少于原研公司,FDA应该确保这些生物仿制药上市后的更长时期内与原研产品类似。”
生产障碍
由于利润可观,包括抗体药在内的生物仿制药将会是许多制药公司角逐的新市场。2010年,强生的抗肿瘤坏死因子(TNF)-α单克隆抗体Remicade销量达到74亿美元,罗氏的Rituxan和抗Her-2受体单克隆抗体赫赛汀(Herceptin)销售额分别达到65亿美元和51亿美元。Remicade在美国和欧洲分别于2018年和2014年专利期满,而赫赛汀和Rituxan在欧洲分别于2014年和2015年专利期满,而在美国皆是到2018年专利期满。
抗体生物仿制药生产者除了要面临生产障碍以及高成本外,还将会面临抗体生物仿制药业务的不确定性。抗体生物仿制药的生产要比常规的小分子药物复杂,而且像生长激素和促红细胞生成素这样的生物仿制药获得批准的机会也较小。
抗体生物仿制药在生产过程中面临的主要困难是糖基化、聚集反应和蛋白折叠,所有这些都可导致免疫原性和抗体靶向改变,从而引起治疗活性的下降。
Medimmune公司生物制药开发部的GailWasserman博士称:“重组单克隆抗体生产技术标准较高,因此对原研产品进行仿制开发从而达到与原研产品具有类似非临床和临床研究中的安全性和疗效将会具有很大的难度。”
替换使用有待确证
到目前为止,欧洲药品管理局(EMA)已接收到包括类风湿性关节炎单克隆抗体仿制药rituximab在内的6种生物仿制药的科学咨询。
2010年11月,EMA发布了抗体生物仿制药新的指导方针,在5个月内公开征求意见。
预计EMA的指导方针将包含单克隆抗体生物仿制药在内的临床试验的要求。不过,与品牌抗体药物获得批准所需的试验相比,针对生物仿制药开展临床试验的深度和广度通常要小得多。然而,EMA并没有提到抗体生物仿制药是否可以替代原研药。
目前正在进行抗体产品开发的MedImmune称:“我们不支持原研生物制品与生物仿制药产品之间的替换使用。”而管理部门对于小分子仿制药与原研产品未经医师准许的情况下在药房中替换使用是允许的。
2010年11月,FDA就2009年制定的生物制品价格竞争与创新(BPCI)法案举行听证会。BPCI法案的制定有助于缩短FDA批准具有高度相似性或者可替换使用的生物制品的批准时间。然而,类似替换使用的标准仍旧是抗体药物面临的一大挑战。就在此次听证会上,美国药品研究和生产商协会(PhRMA)的一些专利药生产者对FDA表示,生物仿制药与原研生物制品的替换使用目前还缺乏科学性。
Rituxan处于十字路口
到2015年,美国、欧洲和日本的生物仿制药的市场将超过20亿美元,抗体生物仿制药的快速增长主要受原研药专利期满、低成本药物需求增加、慢性病与并发症生物药物需求增加等因素影响。
据分析师预测,Rituxan将会成为生物仿制药开发者的首批目标。Rituxan在欧洲上市主要是用于治疗复发、难治低度或滤泡性CD20+非霍奇金淋巴瘤。
今年1月,山德士宣称开始对Rituxan生物仿制药治疗类风湿性关节炎进行Ⅱ期试验。山德士还表示将在奥地利Schaftenau建立产量很高大规模的生物仿制药生产线。
最大的仿制药生产商以色列梯瓦制药与瑞士的合同组织Lonza建立了生物仿制药合作伙伴关系,目前梯瓦正在开发的TL011是Rituximab的生物仿制药,而且也在进行类风湿性关节炎和非霍奇金淋巴瘤的临床试验。
另外,今年1月6日,Spectrum称公司也计划与加拿大的合作伙伴Viropro一起开发Rituxan生物仿制药。
成本和投资收益
把抗体生物仿制药推向市场将会花费巨额资金,只有部分公司能够承担得起。据美国投资公司CollinsStewart估计,开发一种适应症的单克隆抗体生物仿制药将会花费1亿美元,新的治疗性抗体的开发将花8~16年和5亿~10亿美元。
另外,生物仿制药尤其是抗体生物仿制药并不如小分子或较简单的生物制品节约成本。据欧洲仿制药协会预测,仿制药每年将会为欧盟节约200亿欧元,不过生物制品并无仿制药。据分析师预测,与小分子药物的仿制药价格平均下降90%相比,生物仿制药价格将会导致下降20%~30%。不过生物仿制药开发者将会在开发和生产投资中寻找最大的回报率,如通过缩短临床前和临床试验等。