浙江工业大学 生物工程学院
摘要:O-乙酰-l-高丝氨酸(O-acetyl-l-homoserine, OAH)是一种平台化合物,可用于生产l-蛋氨酸和其他有价值的化合物,但产量低和转化率低等问题限制了其工业化生产和应用。为了解决这一问题,本研究以前期构建的l-高丝氨酸宿主大肠杆菌HS33为底盘,采用系统代谢工程策略构建了一株高产OAH的菌株。首先,强化磷酸烯醇式丙酮酸(phosphoenolpyruvate, PEP)积累、丙酮酸利用以及OAH合成途径(过表达aspB、aspA、thrAC1034T),获得积累13.37 g/L OAH的初始菌株;随后,整合筛选的辅因子供应基因解决还原力和能量供应问题,将产量提升至15.79 g/L;之后,进一步强化乙酸回用途径,改善乙酰辅酶A供应,结合多源乙酰基转移酶MetX表达使得改造获得的工程菌株OAH28的OAH产量提升至17.49 g/L。最终,在5 L发酵罐中进行生产性能测试,工程菌株OAH产量达到47.12 g/L,葡萄糖转化率为32%,生产强度为0.59 g/(L·h)。上述研究结果为OAH的代谢工程改造实现产量提升提供了一定的理论基础,也为工业化生产提供了有效的借鉴和参考。
O-乙酰-l-高丝氨酸(O-acetyl-l-homoserine, OAH)是一种乙酰化且含有酯基的非必需氨基酸,不参与蛋白质合成,但OAH是细胞代谢过程中重要的含硫化合物合成前体,如l-甲硫氨酸(l-methionine, l-Met)、S-腺苷甲硫氨酸[1]。此外,OAH作为重要的平台化合物,在l-高丝氨酸(l-homoserine, l-HS)、γ-丁内酯等重要化学品的合成中具有潜在应用价值[2]。目前国内外OAH的生产方法主要分为化学合成法和生物合成法。近年来,由于石化行业造成的严重环境问题,以工程菌株利用可再生资源可持续生产OAH在行业内受到了普遍关注。
大肠杆菌(Escherichia coli)因其具有清晰的遗传背景和成熟的CRISPR/Cas9基因编辑工具,常用作氨基酸生产的工业底盘细胞[3]。经系统的代谢工程改造,大肠杆菌可以高效生产l-HS,其是OAH合成的关键碳骨架前体,因此以l-HS生产菌株出发改造大肠杆菌来生产OAH可以保证充足的前体供应[4]。需要指出的是,大肠杆菌中缺少内源性高丝氨酸乙酰转移酶(l-homoserine acetyltransferase, MetX),野生型菌株无法有效合成OAH。常见的棒杆菌属、节杆菌属和芽孢杆菌等微生物中存在天然的高丝氨酸乙酰基转移酶,如谷氨酸棒杆菌(Corynebacterium glutamicum)[5]、迈氏钩端螺旋菌(Leptospira meyeri)[6],这为OAH在大肠杆菌中的异源重构奠定了基础。Wei等[7]通过敲除OAH降解与竞争代谢途径中的基因,消除副产物的积累,增加草酰乙酸的供应并促进前体物质l-HS的合成,增强OAH途径碳通量;然后对来自L. meyeri的MetX进行酶工程改造,并过表达乙酰辅酶A合成酶(acetyl-CoA synthetase, ACS)和丙酮酸脱氢酶(pyruvate dehydrogenase, PDH),使工程菌的OAH产量在摇瓶中达到12.1 g/L,7.5 L发酵罐中达到62.7 g/L;本课题组前期也筛选了蜡样芽胞杆菌(Bacillus cereus)来源的metXbc/meta,用于重建大肠杆菌W3110中OAH的初始生物合成途径,结合降解和竞争途径的破坏和中心碳代谢的碳流重分配,在摇瓶水平积累8.29 g/L OAH。该工程菌株在补料分批发酵过程中产生了24.33 g/L的OAH,转化率为0.23 g/g葡萄糖[4]。
为了实现OAH的高效积累,其合成前体l-HS的供应是关键。l-HS可以通过2条途径合成,分别是天冬氨酸转氨酶AspC参与的三羧酸循环(tricarboxylic acid cycle, TCA)还原型支路(AspC途径)和天冬氨酸氨裂解酶AspA参与的TCA氧化型支路(AspA途径)。理论上,AspC途径每消耗1 mol葡萄糖,可固定2 mol CO2,同时生成2 mol l-HS,但该途径也伴随着6 mol的NADPH消耗[8]。NADPH是胞内重要的辅因子,当以AspC途径为主合成途径时,易导致胞内还原力失衡,影响细胞的生长与生产。在大肠杆菌生产l-HS的研究中,提高胞内NADPH水平是提高目标产物产量的有效手段,所以优化NADPH的供应对于OAH合成也具有重要意义[9]。此外,合成途径多个节点如葡萄糖激酶Glk和天冬氨酸激酶LysC等需要消耗ATP (图1),这对菌株的能量供应又提出了要求。充足的能量供应,一方面可维持自身生长,另一方面则为OAH的合成提供能量保障。相关研究也表明,大肠杆菌生产l-HS时会积累乙酸[10],导致代谢分流,从而降低工程菌株生产OAH的糖酸转化率。Lin等[11]发现大肠杆菌可以将乙酸盐作为碳源进行回收利用,生成了更多的乙酰辅酶A,提高了细胞对乙酸盐耐受性以及对碳源的利用率。
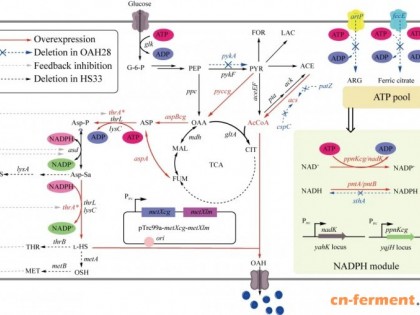
在前期研究中,本团队通过系统代谢工程改造获得了一株高产l-高丝氨酸的生产菌株HS33[5],具有很好的OAH合成潜能。本研究以HS33为研究对象,通过对OAH合成途径的丙酮酸(pyruvic acid, PYR)、草酰乙酸(oxaloacetic acid, OAA)和天冬氨酸(aspartic acid, ASP)节点的平衡强化,筛选并整合辅因子供应基因,解决胞内NADPH及ATP的供应问题,进一步强化前体物质乙酰辅酶A的供应,在多源MetX多拷贝表达的基础上获得一株高产的OAH工程菌株OAH23 (图1)。该菌株在5 L发酵罐中OAH产量为47.12 g/L,为后续的OAH的工业化生产提供了技术和理论支持。

图1 O-乙酰-l-高丝氨酸的合成途径及改造策略 ACE:乙酸;ASP:天冬氨酸;Asp-P:天冬氨酸磷酸;Asp-Sa:天冬氨酸半醛;ARG:精氨酸;CIT:柠檬酸;MET:l-甲硫氨酸;FOR:甲酸;FUM:富马酸;G-6-P:葡萄糖-6-磷酸;LAC:乳酸;l-HS:l-高丝氨酸;LYS:l-赖氨酸;MAL:苹果酸;OAH:O-乙酰高丝氨酸;OAA:草酰乙酸;OSH:O-琥珀酰高丝氨酸;PEP:磷酸烯醇式丙酮酸;PYR:丙酮酸;TCA:三羧酸循环;THR:苏氨酸。
Figure 1 Synthesis pathway of O-acetyl-l-homoserine and modification strategies in this study. ACE: Acetic acid; ASP: Aspartic acid; Asp-P: Aspartic acid phosphate; Asp-Sa: Aspartic acid semialdehyde; ARG: Arginine; CIT: Citric acid; MET: l-methionine; FOR: Formic acid; FUM: Fumaric acid; G-6-P: Glucose-6-phosphate; LAC: Lactic acid; l-HS: l-homoserine; LYS: l-lysine; MAL: Malic acid; OAH: O-acetyl-l-homoserine; OAA: Oxaloacetic acid; OSH: O-succinyl-homoserine; PEP: Phosphoenolpyruvate; PYR: Pyruvic acid; TCA: Tricarboxylic acid cycle; THR: l-threonine.
2
结果与分析
2.1 OAH生物合成途径的构建与强化
以实验室前期构建的HS33为出发菌株,将metI基因回补,恢复其l-甲硫氨酸内运能力,改善细胞生长,获得HS34菌株。在该菌株中用pTrc99a质粒导入谷氨酸棒杆菌来源的metX (OAH1),其摇瓶OAH产量达9.81 g/L (图2),说明其具有良好的OAH生产潜能。OAH合成过程中,l-HS和乙酰辅酶A两个前体可竞争性利用丙酮酸,且丙酮酸仅需一步反应即可合成乙酰辅酶A,具有更高效的拉动力,可能导致碳流分配不平衡,因此需要对丙酮酸的积累进行弱化。磷酸烯醇式丙酮酸(phosphoenolpyruvate, PEP)通过丙酮酸激酶(pykA和pykF编码)催化合成丙酮酸(pyruvic acid, PYR)。Li等[4]敲除基因pykA后OAH积累达到8.29 g/L,在此基础上进一步敲除pykF,目标产物产量下降至6.43 g/L,说明完全阻断PYR合成途径不利于OAH积累。因此在OAH1基础上敲除pykA,OAH产量达到11.25 g/L (OAH2),比对照组提升了14.7%,乙酸含量从原来3.68 g/L降低至2.91 g/L (图2),说明削弱PYR合成可以减少杂酸的积累,同时也可重新分配PYR/PEP节点的碳通量,从而利于OAH的合成。
OAA作为TCA循环的中间体,是ASP合成的关键前体。研究表明谷氨酸棒杆菌来源的丙酮酸羧化酶PYC能够将1分子PYR转化为OAA,同时可固定1分子CO2,具有原子经济性,因此过表达pyc得到菌株OAH3。该菌株OAH的产量比对照(OAH1)提升了9.8%,达到10.77 g/L。此外,OAA的含量也提升至3.42 g/L,乙酸积累量降低至3.26 g/L (图2),但该工程菌株的最大生长OD600降至7.96,可能是PEP被竞争用于合成OAA降低了PYR的供应,从而导致菌体量下降。随后,进一步测试了强化ASP合成途径对OAH积累的影响,该途径可分别由AspC和/或AspA参与[13]。通过在OAH1中组合表达谷氨酸棒杆菌来源的aspB (aspC同源基因)与内源性aspA基因使得菌株OAH4产量比对照提升了26.4%,达到12.40 g/L。由于OAA到ASP合成途径的增强,菌株OAH4的OAA含量降低至1.96 g/L (图2),乙酸含量也进一步减少了1.46 g/L,说明过表达aspB和aspA增强了OAH主代谢途径,将更多的碳流拉向目标产物合成,而用于菌体生长的碳流相对减少,导致OAH4菌体量比对照下降10.0%。ASP合成l-HS需要天冬氨酸激酶,天冬氨酸半醛脱氢酶和高丝氨酸脱氢酶参与,其中由thrA所编码的天冬氨酸激酶被证明为l-HS合成途径的关键限速基因。为进一步将碳流从ASP拉向l-HS,将Ptrc驱动的解除反馈抑制的thrAC1034T整合至OAH1的假基因位点ygaY上,构建了菌株OAH5。该菌株的发酵结果显示,过表达thrAC1034T将OAH产量提升至11.72 g/L,提升了19.5%,并且菌株的生物量相对于对照菌株没有明显变化。
将测试的有效位点(aspB,aspA,pyc,thrAC1034T)以Ptrc启动子驱动串联整合至OAH2的假基因位点ygaY上,获得OAH6菌株。发酵结果显示这些位点的组合强化可将OAH产量提升至13.37 g/L,与对照组相比,尽管细胞生长略有下降,但OAH的产量增加了36.3%。有机酸含量检测显示,工程菌株OAH6的OAA含量降低至1.59 g/L,乙酸积累1.70 g/L (图2),表明同时组合强化各节点,可以有效拉动代谢碳流,减少中间代谢副产物的生成,从而获得性能良好的OAH出发菌株。

图2 OAH主合成途径强化对工程菌株生产及有机酸积累的影响
Figure 2 Effects of main synthetic pathway enhancement on OAH production and organic acid accumulation of the engineered strains.
2.2 NADPH与ATP协同供应改善底盘菌合成OAH
在OAH合成代谢途径中,关键前体l-HS的合成依赖于NADPH和ATP的供应。围绕NADPH供应问题,在OAH6菌株中分别构建了sthA敲除以及在该位点整合由Ptrc启动子驱动的pntAB基因的菌株OAH7和OAH8;发酵结果显示,与OAH6相比,OAH7的产量提升了5.8%,达到14.15 g/L,而OAH8的产量提升更为显著,为14.50 g/L;对其胞内的还原力进行检测,OAH7的NADH浓度从0.29 µmol/L降低至0.25 µmol/L,而NADPH浓度无显著变化;OAH8中的NADPH浓度从0.16 µmol/L提升至0.20 µmol/L,同时NADH/NADPH的值降低52.9%。以上结果验证了转氢酶系统重构可有效提升胞内NADPH含量,为细胞积累OAH提供正向驱动力。为进一步改善胞内还原力供应,拟对NADPH进行开源节流。研究表明,大肠杆菌基因组存在80个编码消耗NADPH酶的基因,其中部分基因的敲除不会影响细胞的生长[14],如yahK、yqjH。此外,大肠杆菌中由nadK基因编码的NAD激酶是胞内唯一一种能够利用ATP作为磷酸供体将NAD+磷酸化NADP+的酶;谷氨酸棒杆菌的ppnK与nadK具有相同作用。因此,在OAH6的基础上,分别在yahK与yqjH基因位点整合nadK与ppnK,获得的OAH9和OAH10产量分别提升至14.37 g/L和14.46 g/L,但细胞生长对比底盘菌株OAH6分别降低了5.2%与5.0% (图3A、3B)。
在上述的改造过程中,一方面因为引入了ATP消耗基因供应还原力,另一方面OAH合成途径中部分催化过程也涉及ATP消耗,如葡萄糖的磷酸化等。有研究表明,在大肠杆菌中存在400个编码消耗ATP酶的基因,抑制其中19个基因,可以增加4-羟基苯乙酸的产量[14]。基于先前的研究,选取artP、mgtA和fecE进行敲除,获得的OAH11、OAH12与OAH13较于出发菌株OAH6菌体量分别提升了13.5%、12.7%与11.4%,胞内ATP水平从0.31 µmol/L分别提升至0.51、0.58和0.54 µmol/L (图3A、3C),相应地,OAH11、OAH12与OAH13中OAH的积累量分别达到14.22、14.17和13.98 g/L,上述结果说明减少ATP消耗有助于改善工程菌株的生长性能,从而提高OAH的合成能力。
基于还原力和ATP供应位点的筛选,在OAH8中逐步叠加上述基因工程改造位点,得到系列工程菌株OAH14、OAH15、OAH16、OAH17和OAH18。在有效位点的整合过程中,OAH的含量呈现逐步增加的趋势,OAH18达到了15.79 g/L,比OAH8增加1.29 g/L。当仅叠加还原力供应相关的基因工程改造时(菌株OAH8、OAH14和OAH15),细胞生长会受到部分抑制,OD600值下降4.4%,但对OAH的积累无显著负面影响。重组菌株OAH15胞内NADH浓度没有发生显著性变化,NADPH浓度从0.20 µmol/L提升至0.25 µmol/L (图4),推测是NAD激酶途径需要与细胞生长竞争ATP,不仅影响细胞生长,还限制了NAD+转化为NADP+。当限制胞内ATP消耗时,重组菌株OAH16、OAH17和OAH18的生物量得到缓解,较出发菌株升高约8.5%−24.1%。OAH18胞内的NADPH水平提升至0.38 µmol/L,NADH/NADPH的值较出发菌株OAH8降低9.9% (图4),且NADPH与NADH的总量均有显著提升,证实了ATP供应不足导致NADPH水平没有显著提升的推测。以上结果表明协同提升NADPH与ATP供应的辅因子工程,对工程菌株积累OAH具有非常显著的正向作用,可以在不损害细胞生长的前提下完成NADPH的供应,从而促进目标产物的高效合成。

图3 胞内NADPH和ATP消耗/供应基因筛选 A:NADPH和ATP消耗/供应基因敲除或表达对工程菌株生长和生产的影响;B:工程菌株胞内NADPH/NADH含量检测;C:工程菌株胞内ATP含量检测。
Figure 3 Screening of intracellular NADPH and ATP depletion/supply genes. A: Effects of enhancing NADPH and ATP supply on the growth and production of the engineered strains; B: Detection of the intracellular NADPH/NADH content of the engineered strains; C: Detection of intracellular ATP level of the engineered strain.

图4 协同供应NADPH和ATP对菌株生产性能的影响 A:工程菌株生长生产性能分析;B:工程菌株胞内NADPH/NADH含量检测。
Figure 4 Effect of synergistically supplying NADPH and ATP on the productive performance of the engineered strains. A: Analysis of growth and production performance of the engineered strains; B: Detection of the intracellular NADPH/NADH content of the engineered strains.
2.3 乙酸回用增强乙酰辅酶A供应对菌株生产性能的影响
为了进一步测试评估重组菌株的生产能力,将OAH18作为出发菌株在5 L发酵罐中进行分批补料发酵(图5A)。在68 h的发酵过程中,OAH的产量在56 h以前随着细胞的增长而不断积累,最高达到29.50 g/L,相较于摇瓶提升62.8%,糖酸转化率为0.18 g/g葡萄糖,生产强度为0.27 g/(L‧h)。发酵过程中随着糖的不断摄入,细胞总量稳定增加,但在发酵初期(0−20 h),OAH积累量极低。随着OAH的产生,l-HS也在稳步积累;当发酵液中碳源耗尽时,OAH容易被分解以维持细胞活性。有机酸的检测结果显示:发酵过程中,细胞在合成OAH的过程中伴随着大量乙酸的积累,最高可达16.84 g/L,而丙酮酸的积累量只有3.75 g/L (图5B)。此外,该重组菌株在整个发酵过程中均有一定量l-HS的积累(摇瓶水平并未发现)。以上结果表明OAH18菌株中l-高丝氨酸前体合成供应充足,可能是MetX的转化效率与前体乙酰辅酶A的供应不足,影响了l-HS到OAH的转化过程。需要指出的是,乙酸积累一方面抑制工程菌株细胞生长;另一方面会消耗乙酰辅酶A,造成OAH合成前体的浪费[15]。
在大肠杆菌中,乙酸可通过ACS催化转化为乙酰辅酶A。因此,对工程菌OAH18的乙酸回用途径进行改造,先后敲除patZ和cspC基因,并将编码乙酰辅酶A合成酶acs基因启动子原位替换为Ptrc启动子,分别获得OAH19、OAH20和OAH21,其摇瓶发酵的细胞生长情况未发生显著变化,主要是因为摇瓶的乙酸含量较低,尚未产生毒性。OAH19、OAH20和OAH21的OAH产量分别可达16.20、16.45和16.82 g/L (图5C),较OAH18分别提升了2.6%、4.2%和6.5%,说明乙酸回用途径对OAH的积累具有提升作用。对3株菌在摇瓶发酵产生的乙酸含量检测表明,敲除patZ后阻断细胞磷酸乙酰基转移酶的合成表达,乙酸含量从1.23 g/L下降至1.02 g/L;在此基础上敲除cspC基因和过表达acs基因可使乙酸含量进一步下调至0.90 g/L和0.55 g/L (图5C),由此证明工程菌株在发酵过程中乙酸回用确实得到了加强。

图5 工程菌OAH18 5 L罐发酵过程控制及其乙酸回用途径强化 A:工程菌OAH18发酵过程参数;B:OAH18菌株发酵过程丙酮酸和乙酸含量;C:敲除cspC、patZ以及过表达acs对菌株生产性能和乙酸积累的影响。
Figure 5 Fed-batch fermentation of the engineered strain OAH18 in 5 L bioreactors and its acetic acid reuse route enhancement. A: Fermentation process parameters of OAH18; B: PYR and ACE contents of OAH18; C: Effects of knockout of cspC and patZ and overexpression of acs on the production performance and acetic acid accumulation of the engineered strains.
2.4 OAH合成关键酶MetX异源筛选和组合表达对OAH合成的影响
MetX参与OAH合成的最后一步,其活性和表达量都决定了OAH的合成强度。来自钩端螺旋体属的L. meyeri和C. glutamicum的MetX具有OAH合成活性[7]。因此,本研究分别以C. glutamicum、L. meyeri和问号钩端螺旋体(Leptospira interrogans serovar)来源的MetX为模板,通过NCBI中的蛋白质序列比对(basic local alignment search tool, BLAST),筛选出高效棒状杆菌(Corynebacterium efficiens) YS-314、腐殖还原棒状杆菌(Corynebacterium humireducens) NBRC 106098、钩端螺旋体属(Leptospira sp.)、问号钩端螺旋体(L. interrogans serovar)、赛塔罗塞钩端螺旋体(Leptospira santatosai)共计6株与模板同源性大于70%的序列,将其分别构建在pTrc99a质粒上并导入菌株OAH21替换谷氨酸棒杆菌来源的metX,摇瓶发酵测试显示表达来自迈氏钩端螺旋体MetX的菌株OAH22的产量仅次于OAH21 (表达谷氨酸棒杆菌来源的MetX),而5种其他来源的MetX虽然表现出了合成OAH的能力,但均有不同程度的l-HS积累。以上结果说明,在MetX活性方面C. glutamicum和L. meyeri来源的基本相当。因此进一步将 C. glutamicum和L. meyeri来源的MetX以串联重复的形式连接至pTrc99a质粒,并导入菌株OAH21中得到工程菌株OAH28,其OAH产量提升了0.67 g/L,达到17.49 g/L (图6),说明多源同工酶在同一个细胞中的表达可能弱化底物的反馈抑制作用,从而提升了OAH产量。

图6 不同来源的MetX过表达对工程菌株生产性能的影响
Figure 6 Effects of overexpressing MetX from different species on production performance of the engineered strains.
2.5 工程菌5 L罐发酵性能评估
为进一步评估工程菌株OAH28规模化生产OAH的潜力,采用分批补料发酵调控策略在5 L罐中进行生产性能测试(图7)。在叠加表达两种来源的metX后,工程菌株OAH28在发酵72 h时生长浓度达到最高OD600=56.8。发酵至80 h时,OAH积累量最高,为47.12 g/L,此时糖酸转化率为0.32 g/g葡萄糖,生产强度为0.59 g/(L‧h) (图7A)。与OAH18菌株相比,其产量提升了29.6%,说明乙酰辅酶A供应和多源MetX强化策略对于OAH合成有正向促进作用。此外,在整个发酵进程中无l-HS的积累,各类有机酸如乙酸、α-酮戊二酸、草酰乙酸等的积累量在发酵结束时均低于3.00 g/L (图7B)。由于菌株为氨基酸缺陷型,在发酵过程中额外添加了l-Thr、l-Met、l-Lys这3种氨基酸,导致在发酵前中期细胞生长浓度较低的情况下,发酵液中能检测到部分l-Thr的残留,最高达到了1.62 g/L;而在发酵结束时,仍能检测到l-Met与l-Lys的剩余,由此推测菌体在发酵培养的前期对l-Thr的需求量略低于后期,而细胞对l-Met和l-Lys的需求在整个发酵过程中较为稳定。

图7 大肠杆菌工程菌OAH28 5 L发酵罐分批补料发酵 A:OAH28菌株发酵过程参数;B:OAH28菌株发酵过程主要有机酸及氨基酸含量。
Figure 7 Fed-batch fermentation of the engineered strain OAH28 in 5 L bioreactor. A: Fermentation process parameters of OAH28; B: Main organic acids and amino acids content of OAH28.
3
讨论与结论
本研究以实验室保藏的HS33作为底盘菌株,通过主合成路径强化、辅因子再生以及乙酸回用策略成功构建了1株工程菌株OAH28。该菌株在摇瓶中发酵OAH产量可达到17.49 g/L。在5 L发酵罐中经分批补料发酵,OAH的产量、得率和生产强度分别达到了47.12 g/L、0.32 g/g葡萄糖和0.59 g/(L‧h),具有良好的工业化应用潜力。
l-HS是OAH合成的主要前体之一,且是OAH的碳骨架,因此OAH代谢合成的关键限速节点与l-HS基本相同。上游途径中,PEP和PYR之间的流量分配决定了碳原子的经济性[17]。pykA基因的敲除可以降低PYR的合成效率,减少PEP的消耗,使其更多地通过PPC一步合成OAA,缩短l-HS的合成路径,此外还可降低以PYR为前体的其他有机酸的积累[4]。为了提升PYR的利用效率,引入谷氨酸棒杆菌来源的PYC,一方面减少PYR在TCA循环的碳原子损失,另一方面帮助细胞呼吸作用产生的CO2被重新固定到OAA中,从而提升碳原子利用率。在下游途径中,AspC和AspA途径的平衡被认为是l-HS合成的关键节点,Mu等[13]采用核糖体结合位点(ribosome binding site, RBS)工程匹配合适强度的apsA提升了合成前体l-HS的产量。本研究采用过表达aspA并匹配异源aspC (aspBcg)以实现OAA和FUM合成ASP的平衡。此外,thrA突变体的过表达是下游合成拉动力的重要来源。
辅因子工程是提升合成途径辅因子依赖性酶催化效率的有效策略,可以实现目标产物代谢通量的最大化。在E. coli的OAH合成途径中,辅因子的生成和消耗存在不平衡性:每合成1分子的OAH需要消耗2分子NADPH[7],因此,NADPH的高效再生可能是影响OAH生物合成的限制因素之一。在E. coli中,大多数增强NADPH供应的代谢工程策略主要集中在加强磷酸戊糖途径(过表达zwf1、gnd1等)和转氢酶系统(在sthA位点过表达pntAB)[13,18]。Mu等[13]在l-HS的工程化改造中证明了pntAB基因整合至sthA位点可以有效缓解高丝氨酸合成过程的还原力供应。然而,PPP和转脱氢酶系统通量的增加导致了不可避免的碳流和能量消耗。因此,Wei等[7]将NADP+依赖的丙酮酸脱氢酶(pyruvate dehydrogenase, PDH)突变体引入工程菌株,将OAH产量提升了10.6%,为辅因子再生提供了新的策略。本研究在转氢酶系统基础上,敲除了NADPH消耗基因yahK与yqjH,并整合了nadK与ppnK,使NADP+得到充足供应,将OAH产量提升至14.46 g/L,但OD值下降了5.0%。考虑到nadK与ppnK供应NADP+的过程消耗ATP,推测是ATP消耗造成的生长抑制。这一推测在后续敲除ATP消耗基因artP、mgtA和fecE积累ATP的工作中得到验证。本研究通过积累ATP池供应磷酸基团并与下游还原力供应系统形成微循环,提供了新的面向OAH合成过程辅因子供应不足的解决方案。
在OAH发酵生产过程中,发现l-HS有一定的积累,这是由l-HS和乙酰辅酶A供应的强度不平衡造成的。大肠杆菌乙酰辅酶A的供应途径有很多,其中乙酸回用是一种有效策略。乙酸的积累不仅浪费碳流,还会造成菌株生长的抑制[19]。对乙酸生成途径pta-ack基因的敲除会严重影响细胞生长[20],因此采用强表达acs减少乙酸积累,同时增加乙酰辅酶A的供应成了OAH合成的首选方法。此外,Seong等[16]在对大肠杆菌乙酸盐耐受性驯化的过程中发现压力感应因子cspC和赖氨酸乙酰基转移酶基因patZ突变有助于菌株对乙酸耐受且利用效率大幅提升。本研究在此基础上,发现cspC和patZ的敲除对乙酸回用确实具有正向效果。研究表明,CspC通过上调rpoS的表达从而抑制acs的转录[21],而PatZ则编码赖氨酸乙酰基转移酶对Acs进行乙酰化修饰失活[22],并且它们的敲除还可供应ATP[16]。因此,对它们的敲除从转录和翻译这2个维度对Acs进行了激活,从而避免了使用异源Acs。敲除cspC和patZ表现的正向促进作用,为OAH工程菌株的构建提供了新的改造参考位点。平衡强化l-HS和乙酰辅酶A供应为最后一个关键酶MetX提供丰富的前体,但其活性和表达量限制了其生产效率。比较了不同来源的MetX,进一步确认了C. glutamicum和L. meyeri来源的MetX具有最优的活性,并且将其组合表达对OAH合成具有更好的效果。
本研究采用的系统代谢工程改造策略显著改善了菌株生长和生产状况,获得了摇瓶水平的已知报道最高产量,但5 L罐的放大结果在产量、转化率和生产强度上皆弱于Wei等[7]报道的工作,可能的原因在于出发宿主HS33敲除了l-苏氨酸、l-亮氨酸以及l-甲硫氨酸合成途径,是一株严格的氨基酸缺陷株,导致发酵罐内控制工艺较为复杂,后续可以从氨基酸合成途径动态回补或者发酵工艺优化这2个角度去改善菌株工业性能。此外,OAH在发酵过程中还存在易降解的问题,这也是影响其产量的重要因素之一,可以考虑低pH或双阶段pH发酵控制工艺以维持其结构的稳定性。总体而言,本研究为OAH菌株的改造和工业化生产奠定了基础,也为代谢工程改造生产其他氨基酸提供了借鉴。