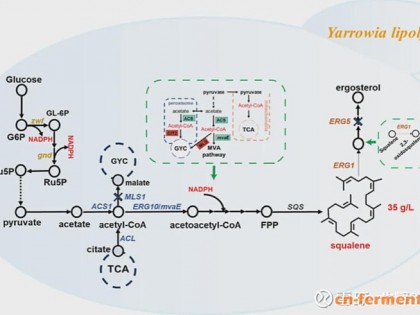
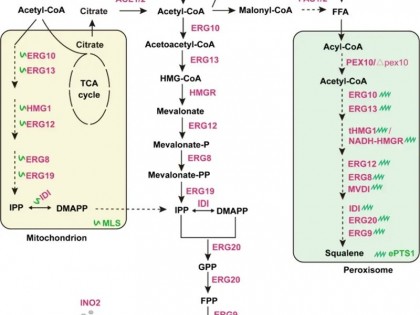
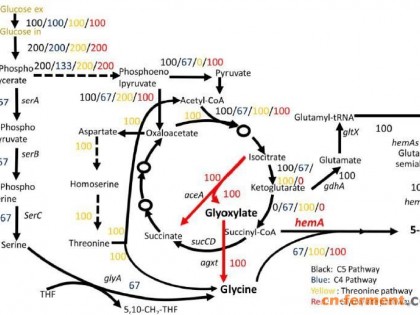
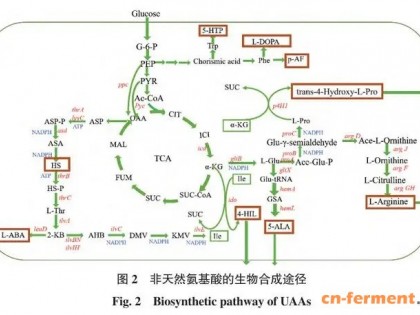
所需特殊试剂:1M IPTG
1. 将目的基因与 IPTG 诱导表达载体连接,构成重组质粒并转化相应的表达用的大肠杆菌。将转化体铺于含相应抗生素的 LB 平板,37℃ 培养过夜。通过酶切序列分析等筛选带有插入片段的转化体。
2. 分别挑取对照菌和重组菌 1 个菌落,接种于 1 ml 含有相应抗生素的 LB 培养液中,37℃ 通气培养过夜。
3. 取 100 微升过夜培养物接种于 5 ml 含有相应抗生素的 LB 培养液中(各 10 份),适当的温度(20-37℃)震荡培养 4 小时,至对数中期(A550=0.1 - 1.0)。
4. 对照菌和重组菌各取 1 ml 未经诱导的培养物于离心管中,剩余培养物中加入 IPTG 至终浓度分别为 0.5,1.0,1.5,2.5,3.0,3.5,4.0,4.5,5.0 mM 相同的温度继续通气培养。
5. 在诱导的 1,2,3,4,5 个小时取 1 ml 样品于 Ep 管中。
细菌的生长速率严重影响外源蛋白的表达,因此必须对接种菌量,诱导前细菌生长时间和诱导后细菌密度进行控制。生长过度或过速会加重细菌合成系统的负担,导致包涵体的形成。生长温度可能是影响大肠杆菌高度表达目的蛋白的最重要因素。低温培养能在一定程度上抑制包涵体的形成。IPTG 的浓度对表达水平的影响也非常大。所以通过试验确定最佳的培养条件是很必要的。
6. 将所有样本室温最高速度离心 1 分钟,弃上清,沉淀重悬于 100 微升 1×SDS 蛋白上样缓冲液中,100℃ 加热 5 分钟,室温最高速度离心 1 分钟,取 15 微升样品上样于 SDS 聚丙烯酰胺凝胶,用 SDS-PAGE 观察表达产物条带,从而确定优化的培养条件。
二、大量表达靶蛋白
1. 取保存的重组大肠杆菌菌液 150 微升接种于 30 毫升含相应抗生素的 LB 培养液中,在 100 毫升锥形瓶中,300rpm,37℃ 通气过夜培养。
2. 取 16 毫升过夜培养物接种于 800 ml 含相应抗生素的 LB 培养液,在 2L 的锥形瓶中用预实验所确定的最佳诱导温度,300rpm,通气培养 4 小时,至对数生长中期。
3. 以预实验确定的最佳 IPTG 浓度,最佳时间和最佳温度诱导表达靶蛋白。
4. 收集菌液,4℃,5000 g(5500rpm)离心 15 分钟收集沉淀,-70℃ 保存。
三、细菌破碎和蛋白质溶解
所需特殊试剂:
非变性裂解液:50 mM NaH2PO4 ,300 mM Nacl ,10 mM 咪唑,pH8.0
超声破碎液:50 mM NaH2PO4 ,300 mM Nacl , pH8.0
1. 每 200 ml 菌液离心所得沉淀以 10 ml 非变性裂解液充分重悬,同时加入蛋白酶抑制剂 PMSF 至终浓度 1 mM。
2. 超声破碎细菌,功率选择在稍低于溶液产生泡沫的水平。工作时间 5 秒,间隙时间 5 秒,总时间 20 分钟(破碎时间一般不宜超过 10 分钟,菌量不超过 1 g)。整个超声过程中探头离烧杯底部 1 厘米为佳,烧杯置于冰浴中。
3. 超声破碎后,取 1 滴菌液于载玻片上,烤干后用结晶紫染色观察超声破碎是否完全,大肠杆菌是否被破碎成球状或球杆状。破碎不完全可适当延长超声破碎时间。
4. 将细菌破碎液以 10000rpm,30 分钟,4℃ 离心,收集上清。用等同于上清体积的超声破碎液重悬沉淀。
5. 分别取 10 微升上清和沉淀重悬液用于 SDS-PAGE 检测,以确定是包涵体表达还是上清表达。其余置于-70℃ 保存。
四、Ni-NTA 亲和纯化带组氨酸标签蛋白的纯化策略
(一)若为上清表达
所需特殊试剂:
非变性裂解液:50 mM NaH2PO4 ,300 mM Nacl ,10 mM 咪唑,pH8.0
Wash buffer:50 mM NaH2PO4 , 300 mM Nacl ,20 mM 咪唑,pH8.0
Elution buffer:50 mM NaH2PO4 ,300 mM Nacl ,250 mM 咪唑,pH8.0
1. 离心后上清蛋白与 Ni-NTA 混匀,冰水浴中于脱色摆床上轻摇 1 小时,使之充分混匀结合。为了完全去除杂质,离心两次或离心后用 0.4 微米微孔滤膜过滤。
2. 将混合物转移至层析柱中,让液体自然流出,速度可稍慢(5-6 秒/滴),收集流出液体。可以取样进行 SDS-PAGE,看蛋白挂柱情况。
3. 用 Wash buffer 洗涤层析柱,洗涤量约为胶体积的 50-100 倍,以便充分洗去杂蛋白。为了洗的更彻底,可以把胶混悬后再让液体流出,中间可以重复数次。因为胶板结之后,洗涤效果可能会差些。
4. 用 Elution buffer 洗柱,用 1.5 mLEP 管收集洗脱液,直至 A280<0.1。
5. 测定收集的洗涤液和洗脱液的 A280,选择 A280 变化明显的管取样进行 SDS-PAGE,分析组氨酸标签蛋白的分布。根据 A280 和电泳图选择合并 A280 相近的管,弃掉没有目的蛋白的管。目的蛋白的脱盐处理可以用透析,也可以超滤,还可以过分子筛。如果需要更大的蛋白浓度,可以使用超滤的办法 。收集的蛋白- 20℃ 保存。
说明:只经过 Ni-NTA 纯化,所得蛋白一般不纯,往往混有杂蛋白。这时可以考虑进一步的纯化措施,比如 DEAE, 分子筛,疏水层析等。
(二)若为包涵体表达
所需特殊试剂:
细胞裂解液:50 mM Tris-Hcl ,100 mM Nacl ,0.5%Triton X- 100, pH 8.0
变性裂解液:10 mM NaH2PO4 ,10 mM Tris-Hcl,8M 尿素,pH8.0
复性液: 100 mM NaH2PO4,10 mM Tris-Hcl,2 mM 还原型谷光甘肽,0.2 mM 氧化型谷光甘肽
Wash buffer: 100 mM NaH2PO4,10 mM Tris-Hcl,pH6.3
Elution buffer: 100 mM NaH2PO4,10 mM Tris-Hcl,pH4.5
1. 将沉淀重悬液缓慢冻融离心,去上清,沉淀重悬于 9 倍体积的 4℃ 细胞裂解液,每克菌体加入 4 mg 脱氧胆酸,悬液室温放置 5 分钟,4℃,12000rpm×15 分钟。洗涤 5 次。
2. 每克沉淀重悬于 9 ml 含 0.1 mM PMSF,10 mM 2 -巯基乙醇,2 mM 还原型谷光甘肽和 0.2 mM 氧化型谷光甘肽的变性裂解液中,调节 pH 在 10.7,室温放置 60 分钟。
3. 再用盐酸调 pH 至 8.0,室温放置 30 分钟。
4. 4℃,12000rpm×15 分钟离心,留上清待用。沉淀重悬于 100 微升 1×SDS 蛋白上样缓冲液中。取 10 微升上清加 10 微升 2×SDS 上样缓冲液,上清和沉淀分别进行 SDS-PAGE,分析溶解程度。
5. 稀释透析复性:每毫升上清缓慢加入 9 毫升 6M 尿素的复性液中。装入经 10 mM NaOH 和 1.0 mM EDTA 煮沸 30 分钟,蒸馏水洗涤干净的透析袋中。在 4℃ 10 倍以上体积含有 2M 尿素的复性液中透析 5 个小时。
6. 取出透析袋,再放入 4℃ 10 倍以上体积的复性液中透析过夜。
7. 取出透析袋中的蛋白,测定其 A280,加入相应体积的 Ni-NTA 树脂混匀,按与上清纯化相同的方法上柱纯化,但是 Wash buffer 和 Elution buffer 用包涵体纯化的 pH 递减的缓冲液。
五、Ni-NTA 树脂的再生
当 Ni-NTA 琼脂糖的颜色由浅蓝色变成灰褐色,此时 Ni-NTA 树脂需要再生后才能使用。
所需试剂:
再生缓冲液:6M 盐酸胍+0.2M 乙酸
2%SDS(m/V)
25%,30%,50%,75% 的乙醇(V/V)
100 mM EDTA,pH8.0
100 mM NiSO4
裂解缓冲液 A:
10 mM NaH2PO4 + 10 mM Tris-Hcl + 6M 盐酸胍,pH8.0
裂解缓冲液 B:
10 mM NaH2PO4 + 10 mM Tris-Hcl + 8M 尿素,pH8.0
1. 用下列试剂依次彻底冲洗层析柱:
-
2 倍柱体积的再生缓冲液
-
5 倍柱体积的双蒸水
-
3 倍柱体积的 2%SDS
-
1 倍柱体积的 25% 的乙醇
-
1 倍柱体积的 50% 的乙醇
-
1 倍柱体积的 75% 的乙醇
-
5 倍柱体积的 100% 的乙醇
-
1 倍柱体积的 75% 的乙醇
-
1 倍柱体积的 50% 的乙醇
-
1 倍柱体积的 25% 的乙醇
-
1 倍柱体积的双蒸水
-
5 倍柱体积的 100 mM EDTA
-
1 倍柱体积的双蒸水
-
2 倍柱体积的 100 mM NiSO4
-
2 倍柱体积的双蒸水
-
2 倍柱体积的再生缓冲液
2. 2 倍柱体积的适当的裂解缓冲液(A 或 B)平衡 Ni-NTA 树脂
3. 将再生后的 Ni-NTA 树脂按 1:1 的比例保存在 30% 的乙醇中