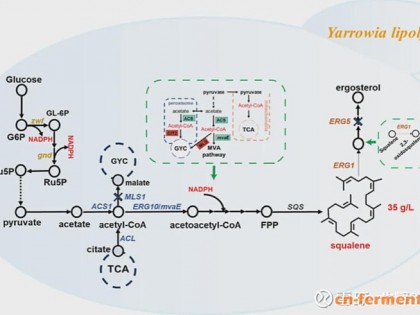
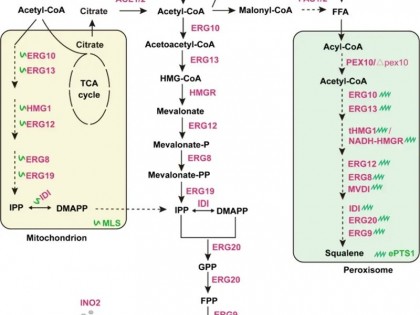
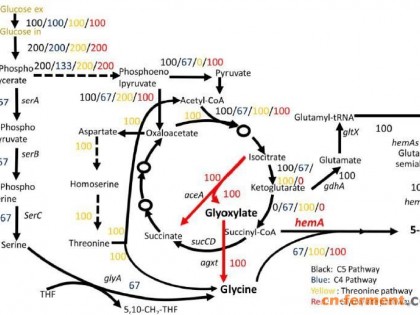
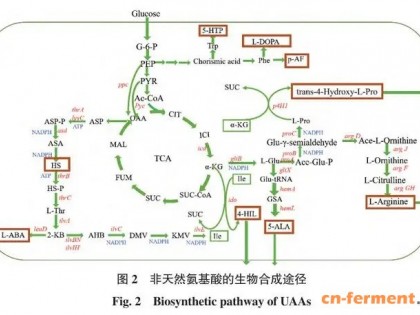
1、懒人是将Biotin直接溶在去离子水中,放过夜,基本就能溶;
2、急性子是将溶液配成0.02N的NaOH,就很容易溶解了;
3、水浴加热,温度不能高于50度。
D-生物素是具有生物活性的生物素,也就是vitaminH。
b.有几个比较迷惑的问题请教大家:(很典型的小问题)
1、制感受态细胞,OD多少比较好?
pyrimidine 战友的方法:取1mlGS115过夜培养物(OD约6-10) 分装到1.5ml EP管中。
说明书还有一些文献是说在1.3左右效率高,再高了效率会很低
2、关于高效转化法,文献说用(LiAc),而invitrogen的说明书说转化毕赤酵母用(LiAc)没用,要用LiCl。
Lithium acetate does not work with Pichia pastoris. Use only lithium chloride.
3、YNB到底能高温灭么?有的说能有的说不能。
过滤灭菌的怎么操作?
我是把滤器装好膜绑到瓶口用纱布盖上,报纸包上,瓶盖放烧杯里单灭。然后把配好的溶液用注射器一点点推进去。
4、葡萄糖为什么在YPD里一起灭颜色很深,单灭则不会。
该115度还是121度灭?网上搜了下,都有人用!
5、电转化参数用400欧还是200欧?有的用400,有的还专门说不是用400。
都是从园里看到的!
电击参数:1.5KV,25uF,200欧姆(不是400)
6、电转后,在MD平板上长的应该就是整合了目的基因的重组子了吧?
如果不想筛 高拷贝的,是否PCR验证一下即可?
网友的回答:
ynb最好不灭菌,我是0.22um过滤处理的。invitrogen手册上可以灭菌的。
glucose和含氮化合物在一起容易产生美拉德反应,这是配制培养基中的禁忌。颜色很深的话,基本不能使用了。
想请教下关于菌种保存的方法。
我现在是采用斜面保存的方法,但感觉每次接菌都要打开斜面,而且每次的接菌量难免会有不少的误差,所以很想问一下大家都是怎么保存菌种的,特别是甘油菌的保存方法。
我一般吸取300ul的菌液到灭菌的EP管然后加等体积的甘油,混匀.防于-20度.保存长的话最好放-80度冰箱一般OD是2-6,过夜菌
在筛选高表达菌种中,我一般有一下步骤,很很多人做的不太一样,和说明书也有点差异,如下:
每次转化前,均用多种酶切,BlgII/salI/sacI同时切,然后转化时,用GS115/KM71/KM71H同时转化,转化的条件也和大家一样,即1.5/25/200但是我用的是0.1的杯子,不是0.2的,转化后涂MM及YPD+0.25G,长出菌落后,即进行大规模的表达试验,这里我要重点说明的是,我直接用YPD表达的,一般48h后即进行大量的SDS-PAGE鉴定,鉴定时,样品不用浓缩,直接上样,看到目的带后再做PCR,测序。
我已用这儿方法做了好几个基因出来。
关于酵母表达时BMMY的PH值
我也觉得PH7.0-7.5要比PH6.0好,我表达的两个蛋白都是这样,表达量要高一些。但也不能一概而论,不同目标蛋白表达最适pH不一样,不过表达的pH值最好要远离目标蛋白的pI。
像目前国内外做的最好的rHSA,最适pH大概5-6左右,也有不同的报道,可能和工艺页有关系。而我自己正在做的一个蛋白pH4较好,3、5表达时上清电泳目标带大量减少,杂带大量增多。
求助一下很棘手的问题,大家在酵母表达过程中控制目标蛋白降解方面有什么高招,小弟最近为这个有点儿焦头烂额。
我试过用酸消解酪蛋白,可是作用并不是很明显。
不知道兄台是胞内表达还是胞外表达,如果是分泌表达,目标蛋白确实容易被降解。你可以尝试以下几种办法:1、尽可能降低培养液的pH值减少酶活,酵母生长pH值比较广,4~7都可以试一下;2、多试几种蛋白添加剂,充当酶解底物;3、摸索最适下罐(摇瓶也一样),宁可少表达点也别给降解光了。实在没办法,只好换菌株或做pcr突变酶切位点(当然不能影响表达和蛋白活性)。
Several strategies have been reported as effective in minimizing the proteolytic instability of specific foreign proteins secreted into the P.pastoris culture medium.
The first is adding to the culture medium of amino-acid rich supplement such as peptone or casamino acid, which reduce product degradation possibly by acting as execess substrates for one or more problem proteases.
The second strategy to minimize proteolytic degradation is to optimize the culture pH between pH 3.0 and pH7.0.
The third strategy involves elevating the level ofammonium in the culture broth adequately, which is explained by the hypothesis that portease activity is induced under nitrogen starvation.
The forth strategy is let the culture temperature 28 deg instead of 30 deg.
如何优化密码子来提高蛋白表达量,具体考虑哪些因素(肯定不是单纯的全部置换为使用频率高的密码子吧)看有些文献优化后的密码子有些都是使用频率不高的,实在很困惑.有没有做过这方面的,急切的想得到你的指导,收取一定的费用也可以。谢谢了,我在上海。
密码子改造对提高表达量只有有限的作用。
影响外源蛋白在Pichia中表达水平的限速步骤(rate-limiting factors)很多。
涉及到转录,翻译,蛋白在ER和Golgi的合成和折叠,以及分泌信号肽定位和切割,蛋白修饰等很多方面(H. Hohenblum, Biotechnology and Bioenginering, 2004, 85:367-374) 。
关键是根据你要表达的蛋白性质以及DNA序列特性来推测(!)哪个步骤是关键的限速步骤。
实际上,很多分泌表达的蛋白,蛋白在ER中合成和折叠以及信号肽的切割是关键步骤。现象是很多错误折叠的蛋白在胞内聚集和降解。
密码子作为限速步骤很多时候体现在某些蛋白由于高AT含量或者其他因素转录提前终止,这方面文献在NCBI上有一些。
我用Pichia酵母分泌表达两个不同的蛋白,结果Western Blot的结果显示,两个蛋白均比理论分子量少了20k左右。难道都是被发酵液中的蛋白酶降解了?大家碰到过这样的情况吗?
如果是少了20K左右,肯定要考虑酶解的可能了.你的目的蛋白一级序列是否有Pichia酵母的Kex2酶降解位点.我现在做的蛋白就有这种情况,但是是降解产物和目的蛋白共存,有的蛋白幸免遇难
用BglII、SalI、SacI酶切 的区别是什么?
我是想做蛋白表达,用BglII后转化行么?
它们三个是不是哪个可以用了?
BglII 好像能把质粒切成两段,与其它两种线性化方法比较,较易生成muts型的转化子,当然比例也是少。
SalI、SacI酶切基本只能产生mut+型的转化子,我看文献介绍,后者的转化效率比前者要高。
我用前者线性化的,感受态也是用常规方法,没有DTT LiCl什么的,板子也是长得满满的。
哪位有毕赤酵母上罐的一些无机培养基配方能提供参考!谢谢!
毕赤酵母基因组DNA PCR怎么也p不出来,
质粒和线性化后的质粒都能P出来,
但是电转化进入毕赤酵母GS115后怎么也p不出来,
不知怎么了?
以前做的都是小菜一碟呀,
那位战友有这方面的经验啊?
是不菌株有问题啊?
恳求指点一下!
非常感谢!
电转化后涂在MD平板上的么?
应该大部分都是阳性克隆,可能是你提基因组的方法有问题,
以前有战友介绍过菌落PCR的方法,我刚试过,效果非常非常好。
2.2kb的片段非常清楚。
退火温度我用的56度1min,72度2min,35个循环。
挑取单菌落均匀涂抹于管底,开盖在微波炉中档加热1min,-80℃5min,再加热一次,然后加入20ul水,取1ul作为PCR模板。
他本来说离心取上清为模板,我就直接取的。
非常非常好用,
一般的方法提基因组,比如煮冻煮法等,很难P出2.2kb的AOX1 基因
而这个方法就能,还非常明显。你翻一下前两页吧,我还把自己的图贴出来了。
选5‘aox和3’aox这两个引物,这样还能判断你的转化子是mut+或muts型的。
跑出两条来说明是mut+,其中一条2.2kb的就是aox1基因。
这里不涉及aox2,建议你去invitrogen网站下一本multicopy pichia expression manual,看一遍就很清楚了。
MD平板上的阳性克隆应该比例很大的,我觉得3个就至少有一个是。
万事都没那么觉对的,在整合时,可能仅His4基因整合入了酵母基因组,所以也能生长,但无目的基因。
请教几个问题
1. 鉴定重组时候,我煮冻煮方法获取酵母基因组作为模板,用目的基因的引物进行扩增,结果有些产物很强,有些很弱,为什么?
2。是否存在这样情况,线性化载体进入酵母内,没有进入核内进行重组,或者进入核内,仅仅黏附在酵母基因组上,没有发生重组呢?
如果有这个情况,该如何区别?
3.用烧瓶摇菌的转速对表达有什么影响,听说过高转速使酵母总处于分裂增殖,而表达低?
4.大家大规模发酵的步骤是怎么样的,能提供一个方案吗?
关于PCR的问题,我觉得你的模板差异大吗?我做很多次PCR鉴定,发觉模板量的差别对PCR的结果会有非常大的影响。不过我做的PCR鉴定,基本上都是用AOX1引物P的,倒是没用过目的基因引物。
摇瓶的问题我也说不出来,因为我到目前为止都没做出分泌性表达来,汗啊……(都在胞内了)速度我都是按照Protocol上的推荐速度摇的,一般都是250rpm以上。
我做的时候使用蜗牛酶消化0.5h,然后沸水浴15min,12000g离心3min,取1ul做模板即可。
再问个有关GAP质粒表达的问题。
小量摇瓶表达的时候需要保证氧通量而使用双层纱布包住瓶口吗?还是直接用牛皮纸包住就行了?
一般说来,小瓶发酵的时候只需要用牛皮纸包住瓶口就可以了,摇床的速度不要过快,那样会使得通气量不够,小瓶发酵时由于不添加消泡剂所以应该避免摇速过快而引起得泡沫。泡沫得产生直接影响到通气的效果。
我们在做大规模发酵时才用纱布将发酵罐的饿通气口都包住,小瓶发酵,那么做得话,可能会导致污染,因为酵母是长得比较慢的。
这个想法可以阿
盐浓度对表达的影响
我想有个问题,缓冲液是起缓冲作用的,
浓度低了影响缓冲效果,浓度高了抑制菌生长?
可以做不同pH的比较试验,
再加上其他的因素,比如转速,所加培养基的量(通气量),甲醇量等
做个正交设计,学了统计,就是不会用阿,呵呵
pH和甲醇浓度我之前都有尝试过。转速啥的没做过。
浓度也是偶然想到的,所以想尝试下。
我的目的基因序列中有一个AAAATT,不知道这个序列是否会影响我的目的蛋白的表达,心里没有谱,希望能有高手指点。
应该不会,现在鉴定出来的导致转录提前终止的序列只有HIV gp120蛋白上一段序列包含TTTTATA。如果不怕麻烦,做一下Northern鉴定,或者直接突变掉一两个碱基。
酵母发酵两三天后有些菌体发红,是怎么回事啊
是突变还是真菌污染呢
我的最近也出现这样情况,是否真的是污染呢?
我的最近也出现这样情况,是否真的是污染呢?
个人认为是老化了
试过同一批转化的克隆,有些克隆在培养几天后就转粉红,但多数克隆没有转变,听说是培养的代数多了,酵母的某个酶发生突变
回纤夫兄:
你的目的基因是1.7kb,有没有加493bp左右的载体序列?你有没有做一个空载体的转化?应该是500bp左右,这样你的带也在2.2kb左右,呵呵
分不清了,可以用a-factor 3‘aox来扩,这样好像增加196
pPIC9K :9276 bp
AOX1基因为2.2kb
以GS115基因组为模板,5’ AOX1/ 3’ AOX1为引物,将扩出2.2kb的AOX1基因。以α-factor/ 3’ AOX1为引物,将不能扩出任何片段。
以整合了pPIC9K的GS115基因组为模板,5’ AOX1/ 3’ AOX1为引物,将扩出2.2kb的AOX1基因以及pPIC9K载体上的493bp,以α-factor/ 3’ AOX1为引物,将扩出pPIC9K载体上的196bp。
另外求助以下几个问题:
1、BCA法测酵母上清总蛋白含量(BMMY)可以么?
详细的见下面的帖子,请在此贴回复,谢谢。
BCA法测酵母上清蛋白浓度的问题
我做的时候是把上清稀释了20倍,然后才落在标准曲线范围内,
蛋白的量是6ug吧(标准曲线范围是0-10ug,是每孔的蛋白量,不是浓度)
那样,也就是说稀释20倍后的上清浓度是6ug除以20ul(96孔板测得,每孔加20ul样品)
未稀释的上清就是6ug/ul,每升就是6g,我的蛋白跑SDS-PAGE,占上清的80%,那我蛋白的量岂不达到克级了!
而通过SDS-PAGE判断,30多mg左右吧,这是怎么回事呢?
请问是否有干扰?就是BMMY培养上清阿
添加了1%的酪蛋白氨基酸,会影响么?
2、用软件分析的SDS-PAGE光密度,是否与其蛋白浓度成正比?
如果一条带是另一个带的3倍,是否蛋白量就是它的3倍?
但我测其蛋白浓度,却相差不是很多?
3、电泳看到我的蛋白占上清的绝大多数,70%以上吧,但上亲和柱,流出液的吸收都在5000mAU,好像大部分都流出了阿,我流速1ml/min,柱子是5ml的,绝对没有过载,因为洗脱时可以看到,我的蛋白才从顶端下来,也就利用了1/10的柱子不到。
这是怎么回事呢?是否也与BCA法测蛋白浓度达到g级有关呢?
我用Lowry法测定的BMMY培养基中总蛋白浓度约200-300mg/L,使用的是Sigma的试剂盒,不过没有加1%酪蛋白氨基酸,我看过的文献BMMY培养基上清总蛋白浓度一般这个范围。
BCA法应该也可以,但是6g/L的总蛋白浓度似乎太高,不过也有可能,因为1升培养基你加了10g酪蛋白氨基酸。
另外你绝对不能根据你所谓的SDS-PAGE的蛋白含量来计算你的蛋白表达量,实际值应该要小很多很多倍,酵母粉、蛋白胨和酪蛋白中那么多的蛋白降解片段和小肽等,电泳上是看不出来的,你过柱时光吸收值5000mAU,这就说明了5000mAU绝大部分是BMMY培养基中的杂蛋白。
感谢husiyi兄出来给我解答!
我也不知为什么BCA法测出来这么高,
我用TCA法将上清沉淀后,跑电泳,后来见蛋白质技术手册上说用TCA法沉淀上清能去除干扰物质,我就测了下TCA沉淀后的蛋白浓度,经过换算,是153mg/L。
TCA法应该不沉淀小肽吧?我记得以前做空载体对照的诱导表达,好像沉淀不出东西。
那我该如何估算我目的蛋白的表达量呢?
我见过都是用SDS-PAGE分析目的蛋白占上清总蛋白的比例阿,然后根据上清总蛋白推算。标准的方法该是什么样呢?
SDS-PAGE上显示不出小肽,显示的只是分泌的蛋白,这样的话推算也该比较准的吧?
我的GS115宿主放在-80°C冻存有两年多了,最近拿出来做了感受态做转化,用的是LiCl法,载体是pPIC9,按照推荐的量最后铺板,生长48h后RDB板上密密麻麻一层,设阴性对照同样也长了一层。我觉得可能是GS115的组氨酸缺陷标记丢失了,于是用RDB &RDBH板筛选(这两个板我没配错可以确定),结果挑了16个单菌落化版在RDB板上也均能生长,我不知道是不是全部冻存的GS115均已丢失标记,大家有遇到过这种情况嘛?能给我一些建议?
我在两年前做过一批酵母转化,用此方法均很顺利的就挑出来阳性克隆,那个时候宿主是刚刚和别人讨来的应该是筛选过的。其他试剂我都重新配过了应该没有问题。
组氨酸缺陷标记丢失不太可能
因为GS115菌株组氨酸基因本身就是整合在基因上组的
保种菌株搞混倒有可能,说不定是一个你以前的转化菌株
"原始单克隆菌重复生长"是这个意思:单克隆菌摇起来再涂板的话,也会长出许多个,它们其实是一种,这对于以后筛选多拷贝重组子来说增加了无谓的困难。
sooow,你好!你说的方法我看到了,正在尝试,只是煮了煮,没有液氮处理,扩了两次,可能是我挑菌后用无菌去离子水稀释的浓度不对,或是其它原因,还没有扩增出来,我会继续摸索条件的。
husiyi 你说的方法在Invitrogen手册上是用96孔板,小孔液体培养的,我看过外文也有在电转化之后,将转化子直接涂不同G418浓度的YPDS平板(不是涂MD平板),我还没有试过这种方法,我现在是要筛选MD板上长出的HIS+重组子,我觉得这个方法不合适,还是对"原始单克隆菌重复生长"有顾虑。因为课题是以应用为主的,必须为后面的高产着想。用极少量的菌涂YPD-G418板,浓度提高,我会尝试的。谢谢你们
依我看过的文献和我们这边表达的至少十几个不同类型的蛋白来看
高拷贝对应高表达在99%的情况下是瞎扯,尤其对分泌表达的蛋白来说
决定蛋白分泌表达水平的一个重要因素是蛋白在胞内正确折叠和信号肽分泌处理过程,很多蛋白表达量太低基本上都是由于这个问题
酵母对二硫键的加工能力有一定局限性,所以二硫键含量较多的蛋白,以及一些很大的蛋白表达不是很好
我个人认为MD板结合G418-YPD板筛选的主要作用是利用两个标记进行“双保险”筛选,保证挑选的克隆基本是整合了目的基因的阳性克隆,但是不代表重组蛋白一定会有表达
影响蛋白分泌表达水平的因素有很多,如:蛋白本身性质、基因剂量(拷贝数)、启动子类型、信号肽种类、细胞内蛋白折叠能力、蛋白降解以及培养条件、诱导起始菌体浓度、诱导时间等等。这些从DNA、转录、翻译到翻译后加工水平的各种因素都可以说是蛋白高水平分泌表达的必要条件,不是充分条件。在起始条件下,可能某一因素是限制条件,如基因剂量。你提高了基因拷贝数,表达有所提高。提高到一定水平,细胞内蛋白折叠能力又成为了限制因素。加入分子伴侣提高了折叠能力,表达提高了,这时蛋白降解问题又出来了。所以具体蛋白要具体分析。能找到蛋白表达水平的特定限制因素那就是水平。就单一强调某一因素而不结合具体表达目标情况,那都是片面的。
毕赤酵母表达系统现在研究的热点包括:
1 寻找新的启动子、信号肽和筛选标志;
2 蛋白折叠、聚合和降解;
3 表达蛋白糖基化;
4 表达全抗体、膜蛋白及富含二硫键蛋白;
5 基础研究包括过氧化物酶体、基因组测序(已完成,正注释)。
哎!我的问题解决了!!!!!!冷丙酮造成的盐共沉淀,不是蛋白沉淀!!!!!
看来我的分泌表达量是太少了,做了半年了,哎!!!!
我该如何优化表达条件,提高表达量呢??我半年的工作时间呀!!!!!!
我也碰到了类似问题。请问,你如何知道是“冷丙酮造成的盐共沉淀”呢?
1.蛋白沉淀为絮状,盐沉淀呈片状晶体;
2.我用tca沉淀做了对照,沉淀两很少,在有丙酮不预热沉淀会很少,不过还是盐沉淀.
就是这样了!
Casamino acid 中文名叫什么呢?
能加热灭菌吗?
酸水解酪素,可以加热灭菌。没有问题。
1、采用pyrimidine 兄弟推荐的毕赤酵母高效转化实验方案,方法附后.果然每个MD板子上长了上千个克隆.但是洗涤菌体后,稀释200倍涂G418板子,在2~4mg的G418上都没有生长.相反,上次每个MD板子上只长了30个左右克隆,在在2~4mg的G418上都有生长.大家知道什么原因吗?
2、在G418板子上长出的克隆,大家都用什么办法,简捷而又准确地知道蛋白是否表达了呢?是否PCR鉴定正确的克隆,都能表达呢?
1.对于能用抗体检测的表达产物,用western blot法,可以直接检测电转化后MD板上生长出来的HIS+转化子,方法就是在BMMY平板上,覆上NC膜(无菌),用牙签将菌落点到膜上,培养几天,期间往平板盖上补加甲醇,因为是倒置的,甲醇挥发可以补充培养里的甲醇消耗. 到时取出NC膜,检测,通过显色圈位置与大小,就可初步判断是否表达与表达量的多少.
2.另外的情况,就是没有抗体可用的. 遇到上千个重组子要筛选的话,真的很头疼,看到很多发表的文献上,用G418浓度梯度,从最小的0.25mg/mL,0.5mg/mL.....,4mg/mL. 操作条件和检测效果真的有这么理想么? ? ?假若1000个重组子里有一个是抗4mg/mL的多拷贝,其他都无抗性,这一个重组子也会增值,可能在每个浓度梯度的板上都会长,在4mg/mL的板上也可能会长出好多个,结果做花了这么多功夫,到底还是就那么一个. (这是推测了,但可能就是事实)
所以当你面对 --几千--个MD板上长出的HIS+转化子时, 是---喜悦还是苦恼呢?!
(除了Invitrogen手册上,在96孔板里传3代,使每个转化子都达到相同的稀释外),还有什么好方法能使每个转化子的浓度均一? 或有什么更简便有效的方法?
用G418浓度梯度,想把梯度放大,少做几板,有什么经验可以参考呀? 请教了
对于楼上的,我也有相同的困惑。如果载体是pPIC9K,pPIC3K,这样转化出的重组子可以进行G418筛选,如果对于普通的载体转化的重组子除了进行营养型筛选,PCR鉴定目的片断已经整合到酵母基因组中,对于其是否表达,表达产物的量多少,大家有没有好点的方法啊?
对于楼上说的鉴定多拷贝的烦恼我也理解,
不过我觉得如果你的转化子很多的话,
也就说明你的转化率很高,
形成多拷贝的几率也越大,
我这几次做的时就是直接点到G418 4mg/ml的平板上,
这样虽然费点事,
但是各个克隆还是独立的,
比较可靠!
G418筛选不能用点的方法,你会发现所有的克隆在高浓度平板上都会长。应该是把MD板上的菌落全洗下来,稀释到一定浓度,然后涂板。
0.25 0.5 1 1.5 2mg/ml,我做了这几个浓度,每个浓度就是一个板,不是很多吧?
可以看到每个板长得菌落数是越来越少,长出来的时间也越来越长。
当然存在你从0.25板上取得可能是抗更高浓度的,可以通过杂交法准确确定拷贝数的,说明书上提到了。
但肯定不存在seventhcat说的那种情况,高拷贝生成的几率是非常低的。
电转化过程,生成了低拷贝的基础上才能生成高拷贝。
我的结果是1.5的表达量最高,2.0的虽然蛋白总量挺高,但目的蛋白并不是最多的。
我们不可能对每个转化子都去比较它们的表达量,而且它们之间差距并不大,我觉得后面的条件优化对表达量的影响更大。
一般的做研究生课题,表达了就达到了你的目的了,可以找上十几个比较一下。
本人刚开始作毕赤酵母表达,碰到了一个实质性问题,我的欲表达蛋白前端有一个信号肽,设计引物时没有注意到这个问题,现在就带着信号肽直接连到载体上了,前面的工作都作完后,发现甲醇诱导表达的上清液中检测不到目的蛋白,不知是不是我引入的这段信号肽影响了目的蛋白的表达,请高手赐教!急!
应该不会,信号肽是被切割后,目的蛋白才分泌到培养基中的,也就是说,只要酵母本身切割彻底,你的目的蛋白就能够在培养基中得到。
这几天做表达,
我觉得我的目的蛋白条带较弱,
而且在前面有不明条带,
我怀疑是被降解了,
不知毕赤酵母本身分泌的蛋白酶都是什么了?
怎么可以避免降解了?
我用的是BMGY/BMMY培养基,
谢谢了!
蛋白酶的成分很复杂,研究没有意义,如果想避免降解,可以注意以下方面:
1.优化培养基PH值,从3到6,不影响酵母生长,用添加缓冲液的方式来调PH值。
2.加入酸水解酪素,1%比例,可作为保护剂。也可以添加一些蛋白胨。
3.降低酵母表达温度,可以试验25度,这样蛋白酶的活性会受到抑制。
请问个位战友:
煮-冻-煮提酵母DNA方法很灵验么
为什么我做了两次都没有呀
用了5AOX和3AOX引物和目的基因的引物都没有个扩出来,以前用化学方法做出来过呀 !
望赐教 !!
煮-冻-煮提酵母DNA方法,我试了6次,只有上次不成功,但是我认为我作的转化肯定没有问题,所以我用玻璃珠法抽基因组DNA,在PCR,2.2kb,目的条带都P出来了,不过就是麻烦了一点。但是这个方法很好用,不管是啤酒酵母,还是PICHIA,都没有问题。
玻璃珠法提取酵母基因组DNA
1)接种到5ml YEPD液体培养基中, 30℃,250RPM过夜培养。
2)把培养液转到15ml离心管,4000RPM离心5分钟,去上清。
3)用3ml 灭菌水洗细胞,离心去上清。
4)把细胞悬浮在500ul 细胞裂解液中,并转到1.5ml Eppendorf管中。
5)加入250ul~300ul玻璃珠, 并加入25ul 5M Nacl.。
6)在蜗旋震荡器上最大速度震荡一分钟。.
7)2000rpm 离心2 minute。
8)用1ml的移液枪把液体转到1.5ml Eppendorf管中。
9)加入500ul Tris平衡酚(ph8.2), 用手剧烈摇1 分钟,13200rpm 离心1 分钟。用1ml的移液枪把水相(上层)转到一个干净的Eppendorf管中。
10) 加入500ul SEVAG(24:1 氯仿: 异丙醇), 用手剧烈摇1 分钟,13200rpm 离心1 分钟。用1ml的移液枪把水相(上层)转到一个干净的Eppendorf管中。
11) 加入 1ml 预冷的95%乙醇并在 -20℃沉淀DNA一个小时。
12) 13200RPM离心5 分钟,去上清, 用70%的乙醇洗两次,把DNA悬浮在500ul的TE中。
13) 加入 50ul EDTA-Sark 和3ul RNase (10mg/ml) ,在37℃孵育30分钟。再加入 2.5ul proteinase K (20mg/ml) , 在37℃孵育30分钟。
14) 加入17ul 5M Nacl , 终浓度为0.15M, 重复步骤9和10。
15)13200RPM离心5 分钟,去上清, 用70%的乙醇洗两次,把DNA悬浮在200ul的TE中。
缓冲液:
细胞裂解液 : 0.1M Tris-Hcl (pH 8.0)
50mM EDTA
1% SDS
EDTA-Sark: 0.4M EDTA(pH 8.0)
2% Sarkosyl
TE : 10mM Tris-Hcl
1mM EDTA (pH 8.0)
to 超马兄,
你说的细胞内外的蛋白都是一样的,
我倒是没做过验证,
但是我总觉得细胞内的应该是带有信号肽的,
如果你说的正确的话,
那么也就是说,
当信号肽分泌到细胞膜的时候,
Kex2信号肽酶切割完了又回到胞内了?
还是外源蛋白有ATG,信号肽没有翻译,
直接从你的外源基因开始翻译?
望赐教!
我上次表达的外源蛋白没有自身的ATG,而且没有kex2酶切序列(当时怕酶切不完全,没有设计),我想信号肽应该是在内质网完成切割的,停留在胞内进行糖基化,磷酸化等修饰。这样胞内带信号肽的外源蛋白量很少,western的时候看不出来,而切了信号肽的外源蛋白占了绝大多数,不知我说的是否正确?.
这次我要表达的外源基因没有自身的信号肽,为一个膜蛋白,我想是否 需要将它自身的ATG也要设计进去呢?谢谢
你说的“信号肽应该是在内质网完成切割的,停留在胞内进行糖基化,磷酸化等修饰。”我觉得是正确的,
毕赤酵母表达载体pPIC9K上的信号肽是引导外源融合蛋白到内质网的,
但是要分泌到细胞外就得靠a-因子,
a-因子是一个13个氨基酸的多肽,
也就是说从内质网出来的蛋白,
在外源蛋白的N末端仍然有13个氨基酸(a-因子),
最后在分泌到细胞外的过程中被kex2酶切割,
成为合适的外源蛋白,
不知是否正确?
望赐教!
1. 磷酸钾溶液手册说要过虑,但能否高压灭菌呢?
2. 未转化的酵母单克隆YPD培养液在摇了16h后,菌体像豆腐渣的,这样正常吗?
1 磷酸钾溶液高压灭菌没有问题
2 肯定不正常,是不是染菌了,涂片看看。
某些外源性蛋白在酵母中表达不理想,但经过基因优化以后有不少蛋白还是可以获得一定量的表达。常见的优化方式有密码子优化及发卡结构消除。我们实验室已经有两个这样的情况通过上述办法得到解决。一个基因的表达主要也就转录和翻译两步。如果说还有一部比较关键的话,也许再加一步分泌(在此,只讨论分泌型表达的情况),这样就算作三步:转录、翻译、分泌。那一步有问题都将导致表达量过低,但就我个人认为转绿应该不是大问题,诸如密码子优化、二级结构消除等优化策略均直指翻译一步且效果不错,最近看到一篇文献,作者针对于其表达的基因从mRNA水平、蛋白质水平分别进行了检测结果发现野生型低表达与优化后告表达在mRNA水平上无明显差别,而在蛋白质水平有较大差别。翻译和分泌我个人认为可能是影响目的蛋白表达的关键环节。先说翻译,密码子的偏好性无疑是影响蛋白表大量的一个关键因素,基因二级结构比如发卡结构也应当是一个重要因素。但是在基因优化过程中一味地选用高效密码子或单一地消除二级结构都不见得有好的效果。因此有关基因优化的策略还希望有高人贡献一下自己的心得或大家一起探索一些可能的策略。最后,分泌一步导致培液中蛋白量过少或没有可能确与蛋白自身有些关系,更换信号肽或选择其它表达方式可能是一条出路。
今天最想和大家讨论也是最想求助与大家的是:如果要通过Real-time PCR去分析一个外源基因的mRNA水平(哈哈,别笑我太奢侈)选择一个什么样的内参合适,beta-actin?GAPDH?酵母中是否也有这些看家基因。我没有能从NCBI上查到酵母中这两个基因的序列。希望有哪位知道的施舍一下。
提高表达量的方法有很多:
1 构建多拷贝质粒
2 选用酵母偏爱密码子
3 增加产物稳定性,在培养基中加PMSF,蛋白水解物等
我也正在进行Pichia的表达,可是在诱导过程的第2,3 天是,酵母液的颜色变红且味道发臭,请问这是污染吗?我一共摇了3次,都是这种情况,请问有什么可以预防的方法吗?
是污染了,我的也曾经出现过这种情况,但我不知道污染的是什么,记得以前也有人讨论过这个问题,好像是一种酵母,也有人说是老化了,预防的话就是严格无菌操作,另外你的培养基是否已经被污染了,我感觉我的就是培养基时间长了,被污染了,重新配了就好了,另外,我不知道你是怎样诱导的,你最好在MD板上划菌,调单菌落,因为有时板上也会长出红色的菌落的啊,good luck!
1、酵母分泌的蛋白酶在pH中性附近活力高。表达液彻底离心后,调节pH避开中性范围。
2、蛋白质几次冻融应该没大的问题,故先分装-20度冷冻保存。
3、另外,可根据情况加入蛋白酶抑制剂。
我用的是Difco 0919-07,的YNB 无氨基酵母氮源, 250g装,
For classifying yeasts based on amino acid and carbohydrate requirements
Ammonium sulfate .....5.0g/L RT
这是 北京拜尔迪生物公司" <sales@biodee.net>的YNB(无氨基酵母氮源),BD 291920(原DIFCO公司),250g,价格:¥680/250g,现货,Ammonium sulfate------5.0g/L,含有硫酸铵,请参考。
134g用1L去离子水融解,就是10X的YNB了,不用加其它成分,过滤除菌就可以,不能高压(我就是这样做的,我们实验室就是买的这家公司的)
G418我们这用的是上海生工的 SD6308, 40mg/mL的
GS115的基因组DNA的提取方法分子克隆上讲的很清楚,采用更简单的方法,就是反复煮冻煮,我就是这样做,扩不出来再煮冻,做了好几轮PCR,最后出来了扩增很亮,结果重复性也很好(当然是用G418对HIS+转化子进行了高拷贝筛选之后的重点菌落做的,需要鉴定的菌落个数也不多,十有七八都是阳性的,需要有耐心).
我还没开始做,现在遇到一个问题是,怎么能使信号肽被完全切掉,一个氨基酸残基都不剩,因为不知道剩下的氨基酸残基会不会影响蛋白的活性,所以现在要先构建一个质粒,使其信号肽能100%被切掉。
所以请教一下高手们关于各种信号肽及其切割位点的信息。
几天以后:最近查了一些文献,α因子信号肽包含83个氨基酸残基的前导肽及后面一段由lys—Arg(Glu—Ala)l-2或Lys—Arg—Glu—Ala—Asp—Ala氨基酸序列组成的间隔肽。膜结合蛋白酶KEX2基因产物识别lys—Arg—C端,STE13基因表达产物则识别(Glu—Ala)或Asp—Ala外侧。前导肽和间隔肽对蛋白质的正确切割和分泌至关重要,但有时由于上述两种基因产物的切割活力不同,会在外源蛋白的N端产生不同的切割位点,使一些分泌的蛋白N端带有(Glu—Ala) 融合序列,即产生酵母信号肽切割不完全现象,也就是我在上面提到的问题。但是还是有很多人用以α因子为信号肽的载体并得到了成功表达。也有一些人采用别的信号肽来克服这方面的问题。迄今我查的基本上是中文资料,所以还要继续努力。
我要做的蛋白N端对活性很重要,所以需要一个信号肽可以完全切掉的载体,目前正在查这方面的资料。各位园友谁比较了解这方面,望多多指教!
有没有人试过低温表达酵母(30以下), 据说有助于蛋白结构的折叠,对分泌表达也有好处. 试过的请说一下,在什么温度下表达,效果如何?
我做的就是在28度下表达的,量还可以至于对于空间结构的影响没有鉴定过.
甲醇酵母表达系统有不少优点,其中以Invitrogen公司的Pichia酵母表达系统最为人熟知,并广泛应用于外源蛋白的表达。虽然说酵母表达操作简单表达量高,但是在实际操作中,并不是每个外源基因都能顺利得到高表达的。不少人在操作中会遇到这样那样的问题,生物通编者特地收集了部分用户在使用EasySelect Pichia expression System这个被誉为最简单的毕赤酵母表达的经典试剂盒过程中的心得体会。其中Xiang Yang是来自美国乔治城大学(Georgetown University)Lombardi癌症中心(Lombardi Cancer Center),部分用户来自国内。
甲基酵母部分优点与其他真核表达系统比较与原核表达系统比较
1.属于真核表达系统,具有一定的蛋白质翻译后加工,有利于真核蛋白的表达优点-+
2.AOX强效启动子,外源基因产物表达量高,可以达到每升数克表达产物的水平++++
3.酵母培养、转化、高密度发酵等操作接近原核生物,远较真核系统简单,非常适合大规模工业化生产。+++=
4.可以诱导表达,也可以分泌表达,便于产物纯化。=+
5.可以甲醇代替IPTG作为诱导物,部分甲醇酵母更可以甲醇等工业产物替代葡萄糖作为碳源,生产成本低++++
+ 表示优胜于;- 表示不如;= 表示差不多
EasySelect Pichia expression System
产品性能:
优点——使用简单,表达量高,His-tag便于纯化
缺点——酵母表达蛋白有时会出现蛋白切割问题
全面产品报告及心得体会:
巴斯德毕赤酵母(Pichia pastoris)是一种能高效表达重组蛋白的酵母品种,一方面由于其是属于真核生物,因此表达出来的蛋白可以进行糖基化修饰,另一方面毕赤酵母生长速度快,可以将表达的蛋白分泌到培养基中,方便蛋白纯化。
毕赤酵母表达载体pPICZ在多克隆位点(MCR)3'端带有his-tag和c-myc epitopes,这些tag有利于常规检测和纯化,而且在MCR5'端引入了alpha factor(α-factor)用以增加表达,并且在表达后α-factor可以自动被切除。在进行克隆的时候,如果你选择的是EcoRI,那么只需在目标蛋白中增加两个氨基酸序列即可完成。另外pPICZ系列选用的是Zeocin抗生素作为筛选标记,而诱导表达的载体需要甲醇——甲醇比一般用于大肠杆菌表达诱导使用的IPTG便宜。
第一步——构建载体
Xiang Yang:pPICZ系列有许多克隆位点可供选择,同时也有三种读码框以便不用的用户需要。
红叶山庄:有关是选择pPIC9K还是pPICZ系列?pPIC9K属于穿梭质粒,也可以在原核表达,而pPICZ系列比较容易操作,大肠和毕赤酵母均用
抗Zeocin筛选(PIC9K操作麻烦一点,大肠用amp抗性,而毕赤酵母先用His缺陷筛选阳性克隆,在利用G418筛选多拷贝),而且对于大小合适(30—50KD)的蛋白在产量上是pPIC9K无法比拟的。
leslie:要做毕赤酵母表达实验,首先当然就要了解这个可爱的酵母了(椭圆形,肥嘟嘟的,十分可爱),她和大肠杆菌长得有较大区别(大肠杆菌是杆状的),因此在培养的过程中要区别这两种菌体,除了气味,浓度,颜色以外,也可以取样到显微镜中观测。大家做毕赤表达的时候应该都遇过这种情况吧,表达过程中染菌(我们实验室曾经污染过各种颜色形状的细菌,那真是一段可怕的经历),如果在不知情的情况下继续做下去,那可以就是浪费大把的时间了。
基本熟悉了毕赤酵母,了解了她生长的喜好(多糖偏酸环境),生长的周期等等情况后,当然更多的精力还是应该花在表达的目的蛋白上,我的表达蛋白有些恐怖,有100KD,本来当然应该放在大肠杆菌中表达,但是为了分泌表达(其实后来发现大肠杆菌pET系列分泌表达系列也不错)和糖基化修饰(主要是这个方面,因为我的蛋白是人源的,表达出来用于酵母双杂,因此需要有完备的糖基化修饰)。这样我的DNA片段由于较长,所以在做克隆的时候也要非常小心,需要注意的是:
①酶切位点不能出现在目的DNA片段中——如果片段长无法避免,可以采用平末端连接;
②虽然α-factor可以自动切除,但是在设计表达的时候,如果在N端不能出现任何多余的aa(比如药物蛋白表达),需要特别留意(说明书上有详细说明:P13);
③有三种不同的读码框(对于pPICZα系列来说就是对上α-factor序列),在设计克隆的时候要反复确定自己的读码框是否正确,这可是致命的问题;
④无论pPICZ还是pPICZα都有TGA(终止密码子),但是pPICZ系列没有ATG(起始密码子),有人认为酵母启动子与外源基因的ATG之间的距离越短对于表达的该基因越有利;
⑤如果不希望有c-myc和His-tag,可以在基因片段末尾加入终止密码子;
⑥Pichia的密码子与酿酒酵母的相似,有关基因表达偏好密码子的问题有人认为没有必要更换,有人认为一定要换,个人认为以产量为主要目的的可以考虑更换基因密码子,而如果片段过长就比较麻烦,不过有许多真核保守蛋白其实是和酵母密码子相似的;
⑦克隆菌株需要有recA,endA,试剂盒带有的TOP10挺好用的(其它像是DH5α都行),但是要注意带有筛选抗生素Zeocin的培养基要用低盐培养基(NaCl减半),这主要是因为怕影响到抗生素作用(Zeocin平板要避光保存);
⑧测序引物可以用α-factor信号引物,也可以用5'AOX1引物;
⑨如果需要高量表达,可以考虑做克隆的时候串联基因片段进行表达,另外也可以在转化酵母的时候重复转化。
⑩目的基因中最好不要含有pro-glu-ser-thr这样的序列,因为这个序列是激活蛋白水解酶的作用底物,会影响表达,另外也不要含有x-phe-x-arg-gln和gln-arg-x-phe-x这样的序列(x=任何氨基酸),因为这些序列容易受到容酶体的切割,而且目的蛋白末端最好是ala,asp,val,ser这样的氨基酸。除此之外许多高A+T含量的基因通常会由于提前终止而不能有效转录,也需要多加注意。
第二步就是将线性化的DNA转化入Pichia酵母中。
Xiang
Yang:EasySelect试剂盒准备了三种菌株:X33,GS115和KM71H。我倾向于选择X33,因为这个菌株转化率和表达量相对而言较高,如果你有电转仪(electroporator),可以尝试一下。如果没有的话,EasySelect也准备了化学转化试剂——EasyComp
Transformation,但是由于转化率的缘故,我建议使用电转仪。
leslie:在得到了正确的序列之后就可以准备转化毕赤酵母了,试剂盒携带有的是X-33,GS115和KM71H这三种毕赤酵母(另外常用的还有SMD1168),每种酵母的特点有些不尽相同(Manual上写的很清楚),其中X-33由于是野生型,因此耐受性比较好,如果担心转化率的话可以考虑这种酵母菌,而GS115与X33一样都是属于MUT+表现型,也就是说可以在含甲醇的培养基中快速生长,但是据说会对外源基因表达有影响,KM71是MUT-型酵母,在甲醇培养基中生长缓慢,但是也有利于翻译后加工,比如形成二硫键,糖基化等等,另外SMD1168则是基因组中的Pep4基因发生突变,造成蛋白水解酶活性的丧失,可以保护表达产物免受降解,促进表达量的提高。
一般来说,如果是胞内表达,应尽量用Mut-细胞,这样得到的蛋白产物中醇氧化酶蛋白量较少而目的蛋白量相对较多(约占Pp总分泌蛋白量的30-90%,如人乙酰胆碱酯酶B变异链的含量占到90%,使下游纯化更易进行。而对于分泌蛋白的表达,无论是甲醇利用慢
(Mut-)还是甲醇利用快(Mut+)的细胞都可应用,如在人血清白蛋白(HSA)(为分泌型蛋白)的表达中就看不出两种类型的细胞之间有什么明显差别。
所以一般手册都会建议同时在这几种菌株中进行转化,这主要是因为不同的基因在不同的酵母菌中可能表达量截然不同,因此在最开始的时候建议多用几种酵母菌实验。
另外有个保存问题,原始酵母菌一定要保存好,因为酵母在传代多次后会影响其转化率和表达量,所以一方面分多管分装保存于-80℃,另一方面如果出现了转化或者表达的问题,在其它方面都没有出错的前提下可以考虑重新取出新菌液(每次都要涂平板挑菌)。
在准备酵母菌的同时也需要准备质粒,由于酵母菌转化对转化质粒的要求较高,量也较大(5-10ug),因此许多时候都会用PEG大提质粒,或者用大提试剂盒,总而言之要准备好足够量的质粒,并且不要忘记也要同时准备空载体以做对照。在转化前质粒需要进行线性化,这主要是为了增加重组率(EasySelect试剂盒表达量高的一个重要原因也就在于其原理是将目的片段整合到载体上,大大的增加了目的片段的表达)。线性化位点个人认为也会影响到表达量,对于基因片段不大的蛋白可以考虑用几个线性化位点同时进行转化筛选,但是如果片段大,就有可能供选择的机会少,而且也有可能遇上没有合适的线性化位点的情况,这个时候也不是说不能进行表达,但是准备的质粒就要增加10倍,另外也可以进行部分酶切(即先进行预实验,掐定时间和酶量保证被切开的质粒有部分是在线性化位点切开而基因片段保存完好)。
在线性化之后的质粒就可以酒精沉淀回收了——中间步骤需要使酶失活,说明书建议是热失活或者EDTA,个人认为前者比较好,主要是担心EDTA对于转化的影响,另外这三种酶失活的温度都是65℃/20min。沉淀回收之后是离心10分钟,用80%的酒精洗涤后风干,这一步需要多加注意保证风干完全,因为有实验证明残留的酒精对于转化的影响颇大。
接下来就是酵母转化了,这是令许多人头疼的一步,也是影响实验决定表达的关键步骤。转化方法有不少,例如电转,化学转化,原生质体转化,其方法的难易程度和转化率高低呈反向递减的,也就是说电转最容易,转化率较高(但要求有电转仪),而原生质体最麻烦,而且效果不好(比较传统),因此不建议使用,EasySelect说明书上这么建议,并且也详细说明了电转,化学转化(EasyComp和LiCl)方法的过程,可以按部就班。需要注意的是:
(电转过程)
①最好每次都从平板上挑酵母菌,用培养过的酵母放置时间不要超过一个星期;
②扩大培养的浓度一定要控制好,个人认为不需要OD600达到1.3-1.5,1.0-1.3的就好,这个时候的酵母比较新鲜,转化率比较高;
③整个感受态制作过程中一定要在冰上操作,离心最好也用冷冻离心机,这是影响转化的关键——为了进一步保证这一点,无菌水可以是冰水混合物,另外山梨醇和电转杯都要预冷;
④电转仪需要预热,所以准备感受态的时候就可以把电转仪打开了,电转后山梨醇的加入要快,曾有人做实验证明晚一秒就会降低转化的数量级,虽然不一定可信,但是我个人也认为这个过程要快,电转后可以看看时间,如果时间过短(比如〈4)就可能说明杂质较多,会影响转化率;
⑤转化后温育是个增加同源重组,增加存活率的过程,需要注意不要感染了大肠杆菌,再加入培养基30℃摇一段时间,可以取部分涂板(不同浓度抗生素),或者也有人将菌短暂离心,弃去上清,剩余全部涂板以保证转化率。
(化学转化)
如果没有电转仪,LiCl转化是一种可供选择的方法,转化率是102到103cfu/ug。
主要过程为:
取过夜活化培养的菌液按1:1000接种于15ml新鲜的YPD液体培养基,30℃培养至OD600达到0.8-1.0;4℃,4500rpm离心5分钟,用8ml冰预冷的无菌水洗涤菌体,倾除洗涤液,用1mL
,4℃,4500rpm离心5分钟,沉淀用50μl冰预冷的100mmol/L LiCl悬浮,最后定容至80-90ml。
LiCl转化 取适量单链鲑精DNA(2mg/mL)煮沸5min,立即置于冰上备用,取上述制备好的感受态细胞12
000rpm,离心15s,吸弃LiCl溶液,按顺序依次加入
50%PEG 240ml
1mmol/L LiCl 36 ml
单链鲑精DNA 25ml
线性化质粒DNA 10 ml (约10mg)
用吸头反复吹打,使细胞沉淀与加入的溶液混匀,30℃静置温育30min,42℃热击20-25min,4500rpm离心10min,吸弃转化液,细胞沉淀加1ml
YPD培养基于30℃ 200 rpm培养2-4hr,取转化混合液100ml涂布含100µg/mL ZeocinTM
的YPDS平板,30℃培养2-3天。
第三步——挑克隆筛选
Xiang
Yang:在protocol中用了许多篇幅来指导这一步,包括如何去通过平板筛选,观测生长速率来确定Mut表现型等。这个过程需要3到5天,而我一般只用用了4个小时进行PCR(AOX引物)筛选。
leslie:完成转化后就是克隆鉴定的过程了,包括高拷贝筛选,PCR鉴定和表型鉴定的过程,其中我做的比较多的是PCR鉴定(因为比较快),具体过程protocol上说的很清楚,其实也很简单,就是冻融破菌进行菌落PCR,但是其中许多具体细节问题也挺让人头痛的,第一就是破壁的问题,许多人用PCR方法进行鉴定都无法得到结果,甚至在表达出了以后还是无法得到这张鉴定图片,主要原因之一就是无法正常释放酵母基因组,一般通过培养菌然后进行沸水和-20℃冷冻循环过程裂解细胞在目的蛋白片段比较合适的范围以内是可以得到好的结果的,但是有时候片段过长,模壁就会阻碍扩增,所以我们实验室会用蜗牛酶(很便宜的酶来的)来帮助溶菌,我看许多实验室也会这么做,不过加入的时间不同而已,其次也有奢侈的用试剂盒的。
第二就是是模板量,个人建议模板真的不要加太多了,按照说明书的上的5ul我觉得还是多了,而且建议总体积不用这么大,当然加入模板的量也与自己培养菌的浓度以及用来冻融的菌数量有关。其次是假阳性和假阴性结果,在Mut-和Mut+情况是不一样的,如果用的是5'AOX引物,KM71H会出现3.6kb的片段,而Mut+则会出现AOX1基因原本长度的片段——大约长2.2kb,因此如果的基因片段长度相似,要注意区分。建议PCR过程中使用多对引物进行反应,包括自己基因的,α-factor的,5'AOX的,都可以,反正各种对照多了有利于比较——当然前提是你不能晕了头。
掉了毛的鸵鸟:巴斯德毕赤酵母包含醇氧化酶-1(AOX1)基因的启动子的转录终止子(5’AOX1和3’AOX1),他们被多克隆位点分开,外源基因可在此插入,此外,载体中还包含组氨酸脱氢酶基因(HIS4)选择标记(HIS4区的整合方式为位点特异性单交换引起的基因插入,整合后使组氨酸缺陷型宿主(his4)恢复野生型.HIS4区或AOX1区位点的整合都使转化子具有HIS4基因,因而可利用表型差异进行筛选,酵母GS115具有组氨醇脱氢酶缺陷型基因his4,可接受含HIS4的载体而具有HIS+表型以筛选转化子.)及3’AOX1区,当整合型载体转化受体菌感受态细胞时,他的5’AOX1和3’AOX1能与染色体上的同源基因重组,从而使整个载体和外源基因插入到受体菌染色体上,在加入甲醇作为唯一碳源的培养基中,外源基因在5’AOX1启动子的控制下表达.在载体中引入Tn903Kanr基因(抗G418)有助于筛选高拷贝转化子,转化子的拷贝数与抗G418的能力有关,通过筛选抗G418能力强的酵母即可获得高拷贝转化子.外源基因是以同源重组的方式插入到酵母菌的染色体中,因此不易丢失,多次传代后酵母仍能稳定表达外源蛋白,具有良好的遗传稳定性.
第四步——表达
Xiang
Yang:将你的克隆在YPD培养基中培育到OD600值达到6.0,就可以离心收菌。用表达培养基(比如BMMY)重悬沉淀,在30ºC培育过夜。
leslie:筛选鉴定出自己的重组子可以说什么都不能证明,还是要看这一步的酵母表达,有许多人在酵母表达上花费了大量的时间——不同于大肠杆菌的两天出结果,一次毕赤酵母的表达就需要起码一周的时间,筛选了上百上千的克隆,但是仍然是竹篮打水一场空,我个人建议如果在筛选完3批以上就可以放弃这一批转化的酵母菌,另外调整进行重新转化。
另外刚开始的时候可以用小量表达,可以用5ml:生长慢型,生长快型,阴性对照(空质粒),阳性对照(可以是曾经表达成功的重组子)和没有进行转化的酵母菌的单克隆,BMGY中培养到OD值2-6,离心收菌(如果怕污染或者麻烦,可以放置酵母菌一段时间,一半为20-30分钟,让菌沉淀下来,小心倾倒去上清培养基获得菌),转入BMMY中诱导表达,这些步骤都需要在超净工作台里进行,如果要区分是否染菌,可以取一些到显微镜下观察,或者闻气味(酸甜的是酵母),观颜色(乳白色的是酵母)。除此之外,如果是小量表达,有可能会在没有达到4天的时间培养基就干了,所以可以适当补充一些,以及在摇床里放置盛有无菌水的深口瓶,来保持摇床里湿度。
诱导物甲醇注意要在超净台中打开,可以分装到灭过菌的瓶子中——当然甲醇是不能灭菌的,而且也要注意在用酒精灯过甲醇瓶口的时候要小心,如果真的引起爆炸那可就损失大了。另外如果觉得每天添加甲醇麻烦,也有人用一次性注射器透过纱布添加甲醇,这个方法可能会造成染菌,慎选。说到纱布就想到了通气性问题,酵母在无氧和有氧的情况下都可以存活,但是在甲醇诱导的情况下毕赤酵母用的是醇氧化酶,自然氧气量对于这一基因的表达影响重大,但是由于害怕感染大肠杆菌,纱布裹的也不能太少,最好专辟出一个摇床进行三十度酵母表达,这样可以考虑将纱布减少到3—5层,同时需要注意的是摇瓶内菌液体积不要超过10-30%。
每天取样出来进行SDS-PAGE电泳鉴定,能这样最好,不过每天做胶跑胶染色真的很麻烦,可以汇集一批同时跑,不过样品一定要煮过冻存,而且每次取样不要反复冻融,最好分装保存——因为蛋白经煮沸变性会不稳定,容易降解。另外为了防止蛋白在分泌出来的过程就降解了(特别是小分子蛋白),也可以通过调节培养基pH值抑制蛋白水解酶的活性(这一方面说明书讲解得详细),还可以加入酪蛋白氨基酸等保护物质,竞争性抑制蛋白水解酶的活性来防止表达产物降解。
如果使用的是分泌型培养基,按道理收集培养基上清就可以进行下一步分析了,但是由于培养基中的蛋白浓度PAGE胶一般是检测不出来的——除非你的表达蛋白量非常大。所以需要进行浓缩,方法有TCA法,硫酸氨盐析,PEG沉淀,透析,超滤等等,当然最简单的就是煮沸蒸发水分浓缩了。另外跑胶的时候同时对照酵母胞内蛋白,以防没有分泌出来。SDS-PAGE的配置参见分子克隆,注意你的蛋白大小与胶的浓度的对应性,如果小到20kD以下,可以考虑用tricine胶,不过是个需要全盘重新准备的过程,要考虑清楚。如果选用的载体是带有信号肽的,虽说是分泌表达好纯化,但实际上毕赤酵母本身还是有本底表达的,而且有时候会造成假阳性,所以最后表达过程需要用Western
blot或者Elasa,通常都是用WB,具体的细节可见Western
Blotting前传:想成为高手吗?系列文章,另外要提一句的是,如果本身蛋白没有合适抗体(如果是利用从大肠表达出来的蛋白做出的抗体也有可能与用真核系统表达出来的蛋白无法发生免疫作用),可以选用anti-myc或者anti-his的,前提当然是你的蛋白没有提前终止。
其它在表达中可能出现的情况包括表达量低,没有分泌表达(针对pPICZa系列),头两天蛋白量较大,无法重复,表达出来的蛋白偏大等等,需要分各个方面分析原因,比如蛋白明明加上了信号肽,但是就是无法分泌出来,这可能是蛋白结构在通过细胞膜的时候受到了阻碍,可能需要重新转化,更换线性化位点或者更换菌株;如果蛋白表达第一天较高,但是之后越来越少,这很有可能是蛋白降解了或者产生了竞争表达;毕赤酵母无法重复的问题比较严重,许多情况下在第一次获得了高量表达之后就再怎么也重复不了这个结果,遇到这种情况真是令人非常痛苦,可是除了重新摸索条件还能怎么样呢?而表达出来的蛋白分子量偏大则是个正常现象,除了糖基化以外还有其它原因,比如二聚体,这些需要进行WB或进一步实验验证。
第五步——发酵和产物纯化
Xiang Yang:我用的是HisTraP Columns(GE
Healthcare),经过简单的纯化之后我可以得到90%的目的蛋白。我的目的蛋白是一个大小为45kDa,可以通过二硫键形成反向平行二聚体(antiparallel
homodimer)的糖蛋白,经过纯化,我通过一个细胞增殖实验(cell proliferation
assay)检测了其活性,结果表明表达出来的蛋白在体外有完全的活性。并且我也在体外利用受体分析了蛋白结合活性,与对照(通过大肠杆菌和Bacular细胞未带tag的蛋白)相比,his-tag有一点副作用。
伊可丽:由于在摇瓶培养中巴斯德毕赤酵母表达外源蛋白的水平往往不能准确地反映罐发酵中的表达情况,使之成为令人头痛的问题。主要原因是在摇瓶培养中,培养液的pH值无法控制,培养物通气不充分及无法控制添加碳源的最适速率。但是为了避免对每一个表达菌株进行繁琐的发酵罐培养条件的实验,仍需摸索表达菌株的摇瓶培养条件,使其产物的表达量与预期的发酵罐培养结果相近。
总而言之,EasySelect系统是一个便于操作的酵母表达系统,我已经使用这一系统表达过15个类似物了,每一个我都获得了超过1mg/1升培养液的纯化蛋白。