浙江工业大学 生物工程学院
摘要:棘白菌素B (echinocandin B, ECB)是第三代棘白菌素类抗真菌药物阿尼芬净的关键前体,是由构巢曲霉菌株发酵得到的次级代谢产物,其发酵效价受ECB合成通路及细胞形态的显著影响。本研究旨在通过对ECB生物合成过程中与转录激活、羟基化、细胞形态等相关的关键基因进行改造,以提高ECB的发酵效价,同时改变构巢曲霉细胞形态以降低发酵液黏稠度。结果表明过表达ecdB和ecdK基因使ECB发酵产量分别比野生菌株提高了25.8%和23.7%,达到(2 030.5±99.2) mg/L和(1 996.4±151.4) mg/L。但与细胞壁合成相关的fksA基因的缺失导致其细胞壁受损,影响了菌株生长和产物合成。对过表达ecdB的工程菌株进行50 L罐分批补料发酵调控,ECB发酵效价达到2 234.5 mg/L。本研究为后续菌株的代谢工程改造奠定了基础。
随着人类免疫缺陷疾病患者数量增加,以及人体器官移植、骨髓移植、微创介入性诊断治疗和抗肿瘤化疗药物使用的增多,系统性真菌感染相关风险正逐年上升。统计数据表明侵袭性真菌感染的年发病率为650万,死亡人数达380万[1]。常见的临床抗真菌药物有多烯类、三唑类、氮唑类、棘白菌素类等[2-4],其中棘白菌素类药物是一类新型抗真菌药物,对念珠菌、曲霉菌和卡氏肺孢子虫等病原性真菌有抑制作用,目前已上市的棘白菌素类药物主要有卡泊芬净(Caspofungin)、米卡芬净(Micafungin)、阿尼芬净(Anidulafungin)、雷扎芬净(Rezafungin)等[5-7],其中卡泊芬净和米卡芬净已先后在国内上市。
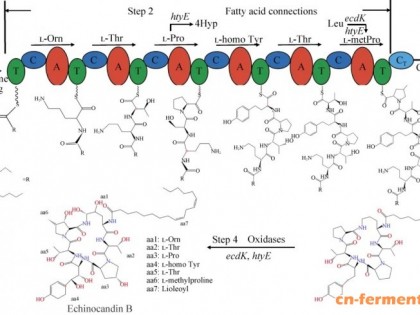
阿尼芬净是第三代棘白菌素类抗真菌药物,具有全新的作用机理,能抑制真菌细胞壁的1,3-β-d-葡聚糖合成酶,其抗真菌谱较广且无交叉耐药性,能用于治疗多种全身性真菌感染疾病。注射用阿尼芬净为美国辉瑞制药公司开发,2006年12月在美国上市,之后华北制药、海正药业、浙江康恩贝制药等企业先后在国内获得了阿尼芬净原料药及注射用阿尼芬净的药物临床试验批件,但由于其前体棘白菌素B (echinocandin B,ECB)的发酵效价较低,目前在国内尚未上市。棘白菌素B由4R,5R-二羟 基-l-鸟氨酸、2个l-苏氨酸、4R-羟基-l-脯氨酸、3S,4S-二羟基-l-高酪氨酸和3S-羟基-4S-甲基-l-脯氨酸等氨基酸组成的环肽加1条亚油酸侧链组成(图1),是构巢曲霉(Aspergillus nidulans)发酵合成的次级代谢产物,其生物合成过程如图1所示。
棘白菌素B的生物合成是一个复杂的次级代谢过程。首先双烯亚油酸侧链连接到ecdA编码的非核糖体肽合酶(Non-ribosomal peptide synthase, NRPS)硫酯化结构域T0,然后在NRPS的作用下,依次连接l-鸟氨酸、l-苏氨酸、l-脯氨酸、l-高酪氨酸、l-苏氨酸和l-甲基脯氨酸这6种氨基酸,最后线性六肽在末端缩合结构域CT催化下发生环化,形成六肽环状母核[8]。如图1所示,其合成主要分为4个过程:脂质体的启动、链状六脂肽的生成、链状六脂肽的环化以及环状六肽母核羟基化氧化,最终形成棘白菌素B。Cacho等研究发现在构巢曲霉中,ECB的生成主要由ecd和hty这2个生物合成基因簇控制[9]。其中ecdA基因编码非核糖体肽合成酶NRPS;ecdB基因编码真菌转录因子;ecdC、ecdD基因编码转运蛋白超家族(major facilitator superfamily, MFS);ecdE基因编码糖基水解酶;ecdF基因编码糖苷酶;htyE、ecdG、ecdK基因编码非血红素铁/α-酮戊二酸依赖型双加氧酶;htyF、ecdH基因编码细胞色素P450血红素铁依赖型加氧酶;ecdI基因编码脂肪酰基-AMP连接酶;ecdJ基因编码未知蛋白;ecdL基因编码ATP结合盒转运蛋白(ATP-binding cassette transporter, ABC);而htyA、htyB、htyC、htyD基因编码生成关键前体l-高酪氨酸的酶[9]。
棘白菌素B结构复杂,目前唯一的合成方式是由构巢曲霉发酵获得[10-13],但在其发酵过程中会出现发酵液黏稠、溶氧传质水平低等问题,导致ECB产量较低。为解决上述问题,研究人员采用菌种诱变、培养基优化、无机微粒添加、培养条件调控及气升式发酵罐培养等方法,取得了一些进展[14-17]。近年来,许多研究人员通过分子操作来提升丝状真菌次级代谢产物的产量,如Chen等通过破坏合成氨基酸的关键基因,将产纽莫康定B0菌株中的副产物纽莫康定A0消除[18]。Wei等采用htyE基因替换洛佐亚棘白菌(Glarea lozoyensi) SIPI1208的脯氨酸羟化酶基因gloF,消除了纽莫康定C0,增加了纽莫康定B0的产量[19]。Min等通过阻断杂色曲霉素的生物合成途径,增加了德氏曲霉(Aspergillus delacroxii) SIPIW15中ECB的效价[20]。FR901379是另一个重要的棘白菌素类抗真菌药物米卡芬净的关键前体,Men等通过过表达与细胞色素P450酶相关的基因mcfH、mcfF及过表达转录激活因子mcfJ,在5 L发酵罐分批补料条件下,使FR901379发酵效价达到了4 g/L[21]。
本研究针对构巢曲霉中与ECB合成过程所涉及的转录激活、羟基化氧化、细胞形态等相关的关键基因进行改造,考察其对ECB生物合成的影响,构建高产菌株,并通过50 L发酵罐调控优化,最终提高ECB的发酵效价,以期为后续菌株的代谢工程改造奠定基础。

图1 棘白菌素B的生物合成机制
Figure 1 Biosynthetic mechanism of Echinocandin B.
2 结果与分析
2.1 过表达转录因子基因对ECB合成的影响
转录因子是一类调控基因转录效率的DNA结合蛋白,主要通过影响转录初始复合物的形成,干预靶基因的转录与表达,在生物体内基因表达的调控发挥着重要的作用[25]。ecdB是构巢曲霉真菌通路特异性转录因子的调控基因,介导的调控具有高度选择性,影响ECB的生物合成基因簇转录。将构建的ecdB过表达质粒通过根癌农杆菌介导的转化,导入构巢曲霉UA-68中。大量筛选发酵结果表明菌落表面颜色为白色、底部颜色为黄色的转化子,其ECB发酵产量较低。因此选取菌落表面颜色为墨绿色、底部颜色为褐色的转化组进行后续发酵实验。以原始菌株UA-68作为对照,与筛选获得的ecdB重组菌株在相同条件下培养发酵10 d后,测定ECB含量,结果如图3所示。其中,重组菌株EB4的发酵效价较对照菌株[(1 613.5±25.0) mg/L]提高了25.8%,达到(2 030.5±99.2) mg/L,生物量与对照菌株相近。据此推测,过表达ECB通路特异性转录因子基因ecdB能加强ECB合成基因簇基因的转录与表达,进而能在一定程度上提升ECB的发酵效价。

图3 基因过表达对ECB合成的影响 *表示具有显著性差异。
Figure 3 Effects of ecdB overexpression on ECB biosynthesis. *: Significant difference.
2.2 过表达氧化和羟基化基因对ECB合成的影响
在ECB的合成过程中,会发生多次羟基化反应,这些羟基化反应的发生依赖于各种氧化酶。ecdK和htyE编码非血红素铁/α-酮戊二酸依赖型双加氧酶,htyE参与将l-脯氨酸羟基化成4R-羟基-l-脯氨酸的反应,ecdK参与亮氨酸氧化成甲基脯氨酸的过程,为母核的形成提供前体物质。将构建的ecdK、htyE过表达质粒通过根癌农杆菌介导的转化,导入到构巢曲霉UA-68中。以原始菌株UA-68作为对照与ecdK、htyE重组菌株在相同条件下培养发酵10 d后,测定ECB含量,发酵结果如图4所示。
其中,过表达ecdK基因的菌株EK4较对照菌株提高了23.7%,发酵效价达到了(1 996.4± 151.4) mg/L,且生物量稍有提高。过表达htyE基因后,其发酵效价和生物量较对照菌株出现显著下降。造成这一现象的原因可能是ECB的环状六肽母核合成需要多种前体氨基酸,包括羟脯氨酸和甲基脯氨酸,在ECB的合成过程中,ecdK是编码参与亮氨酸氧化成甲基脯氨酸氧化酶的基因,过表达ecdK基因,加强了亮氨酸氧化成甲基脯氨酸的能力,使得环状六肽母核前体氨基酸之一的甲基脯氨酸生成增多,利于更多的环状六肽母核形成,从而提高了ECB的产量。而htyE基因的过表达,加强了脯氨酸向4R-羟基-l-脯氨酸转变的羟基化反应,使得脯氨酸供应不足,从而影响了环状六肽母核的形成,导致ECB产量出现下降,因此后续还应对多个相关基因进行调控改造。

图4 过表达氧化和羟基化基因对ECB合成的影响 *表示具有显著性差异。
Figure 4 Effects of ecdK (EK4) and htyE (HE8) gene overexpression on ECB biosynthesis. *: Significant difference.
2.3 过表达转运蛋白基因对ECB合成的影响
ECB是一种胞内次级代谢产物,有研究表明构巢曲霉几丁质重复结构上的羟基基团会减少ECB与葡聚糖合酶的结合,因此,构巢曲霉有耐受较高浓度ECB的潜力。ATP结合盒转运蛋白ABC能利用ATP能量跨生物膜转运抗真菌化合物等。ecdL编码转运蛋白ABC,调控多种药物的转运。转运蛋白超家族MFS是已知最大的次级主动转运蛋白超家族,负责运输广谱底物,ecdC、ecdD基因则编码转运蛋白MFS。为了增加ECB的外排,削弱产物对产物合成的负反馈抑制,提高ECB的产量,本研究在UA-68中过表达关键基因ecdC、ecdD、ecdL。以原始菌株UA-68作为对照与ecdC、ecdD、ecdL重组菌株在相同条件下培养发酵10 d后,测定ECB含量,发酵结果如图5所示。
由图5可以看出,强化转运蛋白相关基因后,对菌体生物量基本无影响,但对ECB的合成则产生了不同程度抑制,使其均呈现下降趋势。分析其原因可能是ECB为次级代谢产物,其合成需要大量前体物质,而强化转运蛋白后可能将部分所需的前体物质转运到了膜外,导致ECB的合成受到影响。

图5 过表达转运蛋白基因对ECB合成的影响 **和*分别表示具有极显著性差异和显著性差异。
Figure 5 Effects of transporter genes overexpression on ECB biosynthesis. **: Highly significant difference; *: Significant differences.
2.4 敲除fksA基因对ECB合成的影响
构巢曲霉属于丝状真菌多核微生物,具有比酵母或细菌等单细胞微生物更复杂的形态。其在发酵过程中会呈现丝状或球状形态,导致发酵液黏稠,影响发酵过程中的溶氧和营养的传质,从而影响ECB的合成。β-1,3-葡聚糖的合成在真菌生长和发育过程中的形态调控中起着重要的作用,fksA为构巢曲霉菌体形态的调控基因,是β-1,3-葡聚糖合酶的编码基因。因此,本研究拟通过敲除该基因调控菌体形态,fksA基因敲除后的菌株扫描电镜分析结果如图6所示,菌株发酵结果如图7所示。
图6显示在敲除fksA基因后,菌株的细胞结构发生了显著变化,图6C中可以看出发酵液中细长菌丝数量增加,且细胞壁表面产生了一定的损伤(图6D)。这可能是敲除该基因后β-1,3-葡聚糖合酶受到抑制,导致菌株细胞壁的合成受到了阻碍,并且在培养过程中发现菌株在敲除该基因后与初始菌相比生长变慢,种子液在培养3 d后仍未呈现橘黄色,上述现象均不利于ECB的合成。图7发酵结果表明重组菌株FK2的生物量和ECB发酵效价较出发菌株均显著下降。这可能是敲除fksA基因后,导致β-1,3-葡聚糖合酶的活性受到抑制,使得β-1,3-葡聚糖量减少,细胞壁结构缺失,菌株生长受到阻碍生长缓慢。ECB属于次级产物且具有一定抗真菌活性,对曲霉菌属有一定的抑制作用,而构巢曲霉凭借着几丁质上的羟基和长链结构,对ECB有较高的耐受能力,敲除fksA基因后破坏了细胞壁结构,进一步破坏或者影响了上述结构,使得构巢曲霉对ECB的耐受能力降低,导致其产量下降。

图6 出发菌株UA-68 (A、B)和fksA敲除菌株(C、D)的扫描电子显微镜分析
Figure 6 Scanning electron microscope analysis of the strain UA-68 (A, B) and the strain ΔfksA (C, D).

图7 敲除fksA菌株对ECB发酵的影响
Figure 7 Effect of knockout fksA gene on ECB fermentation.
2.5 棘白菌素B高产菌株在50 L发酵罐中的发酵调控
构巢曲霉为丝状真菌,在其发酵过程中会以不同的菌丝体形态存在,而不同的形态都会造成发酵液黏稠;同时,培养基中含有黄豆饼粉等难以溶解的物质,这些物质容易使菌体附着在其表面,进一步造成传质和溶氧受限,因此发酵罐中的发酵调控尤为重要。对丝状真菌发酵过程而言,适当提高转速能在一定程度上提高发酵液中的溶解氧,但高转速引起的强剪切力也会对菌丝体造成损伤,不利于产物合成。因此,本研究首先考察了发酵过程中的搅拌转速,探究了其对ECB发酵效价的影响,实验结果如图8所示。
由图8可知,当利用3种不同的转速进行发酵时,pH的总体趋势是大致相同,而且在168 h达到了最高值,然而后期呈现下降趋势。当转速由100 r/min提高至400 r/min时,棘白菌素B的发酵效价由425.36 mg/L提高至688.69 mg/L,这可能是因为高转速有助于菌体更有效地吸收营养,从而促进菌体的增长速率。图8C也表明随着转速的增加,生物量也呈现上升趋势,当速度为400 r/min时,生物量在168 h内达到最大生物量75 g/L,且不同转速下生物量基本都在24 h达到最大值。同时,图8D中溶氧数据表明高转速可以在一定程度上提高溶氧水平,且采用3种不同的转速时,发酵过程溶氧变化规律基本一致,发酵前120 h溶氧均逐渐降低,后期逐渐回升。对比ECB在120 h后的合成过程可以发现,该时期菌丝进入次级代谢阶段,ECB合成速率加快,此时应提供足够的氧气,以提高其代谢合成效率,因此后期如果采用分段控制转速提高溶解氧水平,对产量提升可能有积极效果。
进一步在上述结果的基础上采用分段控制转速调控发酵过程,考虑菌体的不同生长阶段对溶氧的需求以及对剪切力的耐受能力,本研究确定了如下分阶段调控策略:在0–48 h,不同转速对溶氧影响较小,采用200 r/min搅拌转速;48–96 h,逐渐提升至300 r/min;96–168 h,微生物进入次级代谢阶段,该阶段为ECB关键合成期,需要充足的氧气,在此阶段逐渐提升至400 r/min;发酵后期进一步提高溶氧以强化次级代谢产物的合成,此时搅拌转速提高至 500 r/min,在上述条件下发酵曲线如图9所示。可以看出溶氧随着分阶段提高转速会相应提高,生物量在前24 h同样快速提高,在120 h时达到最大值75.82 g/L;在120 h时,ECB合成速率最大,发酵结束时ECB的效价可达864.30 mg/L,较400 r/min恒定搅拌转速时提高了25%。说明根据菌体的生长调控转速可以为发酵过程提供充足的氧气,积累中间代谢物,对棘白菌素B次级代谢产物的生成产生积极作用,所以在后续的发酵罐放大中采用分段控制转速。
除搅拌转速外,前期研究发现底物油酸甲酯对ECB的合成也具有显著影响。因此本研究进一步优化了油酸甲酯的分批补料方式,根据其生长和产物代谢情况优化了油酸甲酯的分批补料浓度,结果如图10所示,在发酵72 h时,开始匀速加入100 mL的35 g/L的油酸甲酯,此时溶氧开始下降,油酸甲酯作为碳源继续消耗,pH继续下降,生物量比前48 h的生物量提升。当发酵到120 h时,溶氧下降到临界氧浓度,通过提高转速和通气量来使溶氧提高到正常水平,而当发酵144 h时,开始加入200 mL的35 g/L的油酸甲酯,此时菌丝开始进入次级代谢,ECB的合成速率开始加快,所以之后每隔24 h补充100 mL的35 g/L油酸甲酯,同时控制pH和溶氧,使其达到合适的范围。发酵144 h时,生物量、pH达到最大值,之后便开始下降。当发酵192 h时,通过控制转速来提高溶氧。在发酵后期转速的提高能够改善溶氧,高转速能够加速菌丝对营养的吸收,使棘白菌素B产量逐步增加。当发酵到264 h时,ECB的产量达到最大值2 234.5 mg/L,比分批补料前提高了110.0%。

图8 不同搅拌转速对ECB合成的影响
Figure 8 Effect of different stirring speeds on ECB synthesis. A: pH. B: ECB titer. C: Dry cell weight. D: Dissolved oxygen.

图9 分段控制搅拌转速对ECB合成的影响
Figure 9 Effects of segmented stirring speed on ECB biosynthesis.

图10 50 L发酵罐中分阶段分批补料发酵过程曲线
Figure 10 Fed-batch fermentation process in 50-L fermenter with high yield strain EB4.
3 讨论与结论
目前研究人员已针对构巢曲霉发酵代谢合成次级代谢产物ECB开展了大量研究,但主要集中在菌种传统诱变选育、发酵培养基优化、发酵工艺优化等方面,而对菌株在代谢过程中所涉及的关键基因的分子改造较少。目前报道的可以合成ECB的发酵菌株主要是构巢曲霉,该菌株为丝状真菌,存在菌株性能不稳定、细 胞形态导致的发酵液黏稠、分子改造效率低等系列问题,虽然ECB在摇瓶中的发酵单位已超过 3 000 mg/L,但在放大培养时仍存在发酵调控 困难等问题,从而导致其发酵放大培养效价不高[26]。因此,本研究对构巢曲霉进行了分子改造,并通过发酵罐中的发酵调控以提高ECB的合成效率。
本研究初步考察了ECB生物合成基因簇中影响其生物合成的关键节点,考察了其对ECB代谢合成过程的影响,寻找影响ECB发酵效价的主要限制因素。通过过表达影响羟基化的ecdK和htyE基因和控制转录因子的ecdB基因,过表达转运蛋白基因ecdC、ecdD、ecdL,探究其对ECB产量的影响。研究表明过表达ecdB、ecdK基因可以增加ECB的发酵效价,重组菌株EB4发酵效价为(2 030.5±99.2) mg/L,较对照菌株提高了25.8%。重组菌株EK4发酵效价为(1 996.4±151.4) mg/L,较对照菌株提高了23.7%。利用同源重组的方式敲除与细胞壁合成相关的基因fksA得到重组菌株,但SEM结果表明细胞壁有一定损伤,摇瓶发酵未表现出较好效果。最后,在50 L发酵罐中优化了棘白菌素B的发酵工艺,首先探究了转速对ECB发酵效价的影响,并对分子高产菌株EB4进行了50 L罐分批补料工艺的优化,经优化后其在50L发酵罐中的发酵效价达到2 234.5 mg/L,是目前放大培养的最高水平。本研究为后续代谢工程改造合成ECB及工业化生产奠定了研究基础,后续应进一步在菌体形态调控、代谢通路改造等方面开展深入的研究工作,加速阿尼芬净的国产化工业进程。